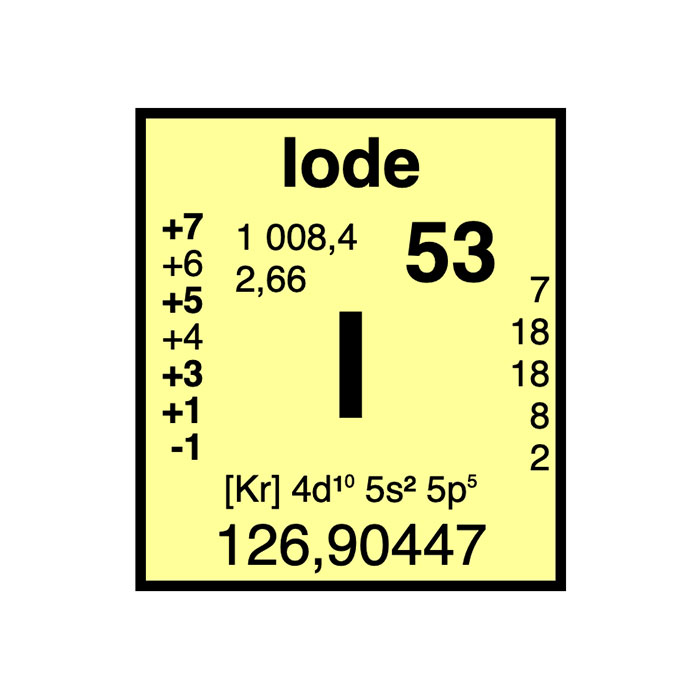
Características del yodo
- Símbolo : I
- Masa atómica : 126,904 47 ± 0,000 03 u
- Número CAS : 14362-44-8(elemento) 7553-56-2 (diyodo)
- Configuración electrónica : [Kr] 4d10 5s2 5p5
- Número atómico : 53
- Grupo : 17
- Bloque : Bloque p
- Familia de elementos : Halógeno
- Electronegatividad : 2,66
- Punto de fusión : 113,7 °C




