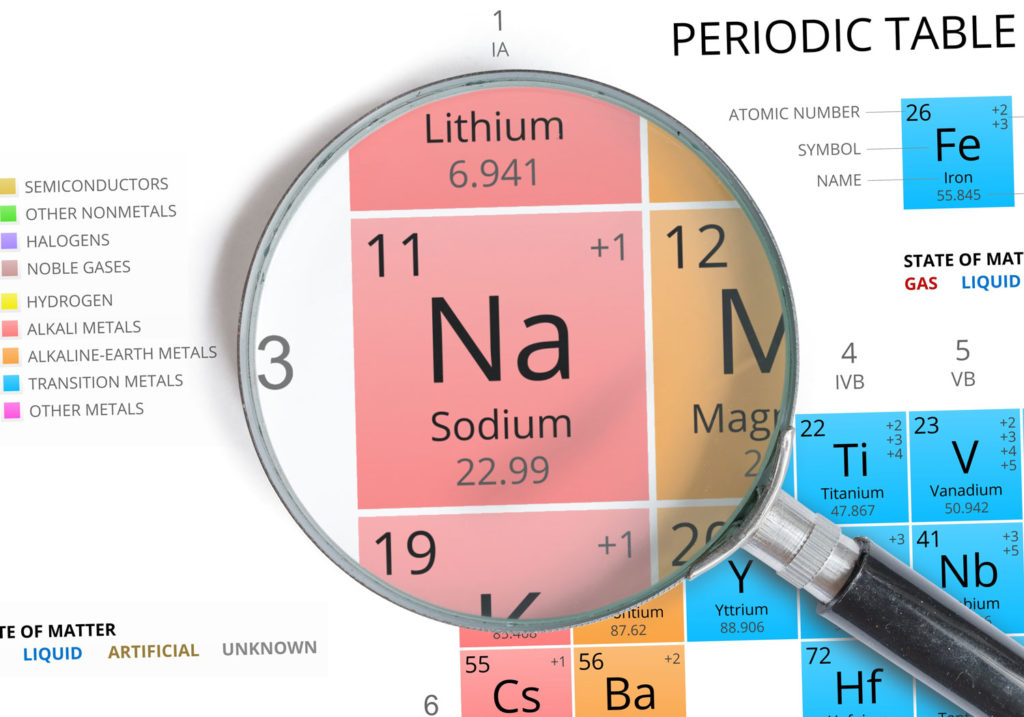
Características del sodio
- Símbolo : Na
- Masa atómica : 22,989 769 28 ± 2 ×10−8u1
- Número CAS : 7440-23-5
- Configuración electrónica : [Ne]3s1
- Número atómico : 11
- Grupo : 1
- Bloque : Bloque S
- Familia de elementos : Metal alcalino
- Electronegatividad : 0,93
- Punto de fusión : 97,80 °C