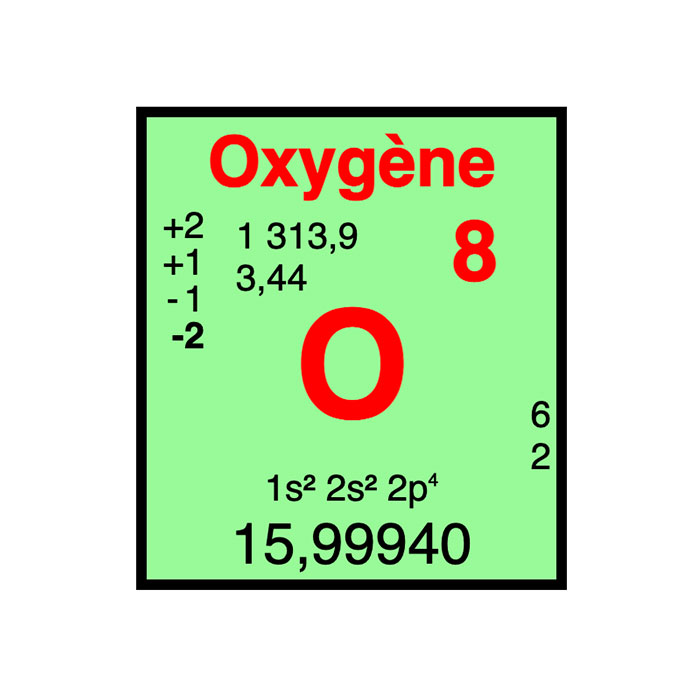
Características del oxígeno
- Símbolo: O
- Masa atómica: 15,9994 u
- Número CAS: 17778-80-2
- Configuración electrónica: [He] 2s22p4
- Número atómico: 8
- Grupo: 16
- Bloque: Bloque P
- Familia de elementos: No metal
- Electronegatividad: 3,44
- Punto de fusión: −218,79 °C



