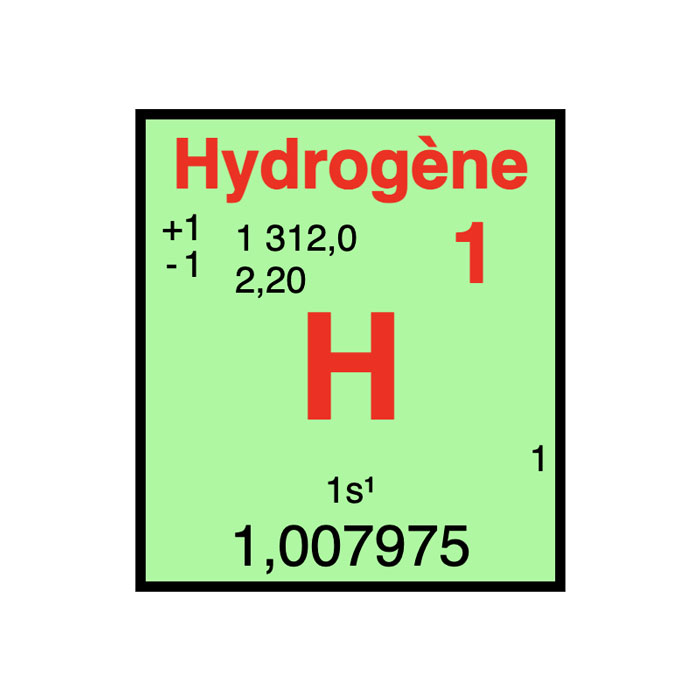
Características del hidrógeno
- Símbolo: H
- Masa atómica: 1,00784 u
- Número CAS: 1333-74-0
- Configuración electrónica: 1s1
- Número atómico: 1
- Grupo: 1
- Bloque: Bloque S
- Familia de elementos: No metal
- Electronegatividad: 2,2
- Punto de fusión: -259,2 °C
NAVIDAD : ¡ Hasta un 50 % de descuento en todo el sitio ! + Regalo sorpresa ! + Sorteo del 01/12 al 25/12: ¡3 Cúmulo de Cuarzo en juego! |

El descubrimiento del hidrógeno se remonta a 1671 durante los experimentos del investigador científico británico Robert Boyle. De hecho, sumergía hierro en ácido para crear lo que se llama una reacción de desplazamiento simple. Por ejemplo, si se añade un trozo de potasio (K) al ácido clorhídrico (HCl), la reacción es la siguiente: 2K + 2HCl ⇒ 2KCl + H2. El metal, especialmente el potasio sólido, reacciona así con el ácido y forma la sal denominada cloruro de potasio (KCl). Los átomos de hidrógeno restantes se acumulan y forman dihidrógeno, el cuerpo simple H2 en estado gaseoso.
En 1766, el investigador británico Henry Cavendish también había puesto de manifiesto la existencia del hidrógeno en estado gaseoso y lo llamó “aire inflamable”. En un artículo publicado en 1776, había confirmado que el hidrógeno es muy inflamable. De hecho, este elemento arde rápidamente o explota en presencia de oxígeno, tras lo cual se crea vapor de agua. Esto hace referencia a lo que se llama una reacción de combustión: 2H2 + O2 ⇒ 2H2O (+ calor). Según esta reacción llamada exotérmica, las moléculas de oxígeno e hidrógeno se combinan y forman agua cuyo símbolo es H2O. Además, genera energía calorífica, especialmente fuego.
Fue en 1783 cuando el químico, filósofo y economista francés Antoine Laurent Lavoisier había designado este gas bajo el nombre de hidrógeno. Esta palabra está formada por el prefijo “hidro-“, que hace referencia al agua, y el sufijo “-geno”, que significa engendrar. Su nombre científico es ahora “dihidrógeno”, aunque generalmente es más conocido con el nombre de “hidrógeno”. Más tarde, otros investigadores descubrirían que el hidrógeno alimenta las reacciones de fusión nuclear que tienen lugar en el corazón de las estrellas. Y son estas reacciones las que crean el calor y la luz emitidos por estas, incluido el Sol.

El hidrógeno constituye el elemento más abundante del Universo, ya que representa el 92% en número de átomos y el 75% en masa. Se encuentra en gran cantidad en el Sol y en la mayoría de las estrellas cuya energía proviene de la fusión termonuclear de este gas. De hecho, el proceso de formación de las estrellas se basa en gran parte en las nubes de hidrógeno. Este último es también el principal constituyente de la materia intergaláctica o interestelar. El hidrógeno existe a menudo en forma de átomos individuales, ya que no colisiona con otros átomos para combinarse. Se encuentra en forma metálica en el corazón de Saturno y Júpiter. Además, está presente en forma de dihidrógeno sólido, gaseoso y líquido en sus capas externas y en los otros planetas gigantes.
En la Tierra, el hidrógeno se encuentra esencialmente en estado líquido (agua), gaseoso (vapor de agua) y sólido (hielo). También está presente en las emanaciones de ciertos volcanes en forma de H2 y CH4 (metano). Por otra parte, el hidrógeno constituye el principal componente del conjunto de las materias vivas, esto en número de átomos. Está asociado al carbono en los compuestos orgánicos. Por ejemplo, el 63% de los átomos y el 10% de la masa del cuerpo humano están formados por hidrógeno. Sin embargo, este elemento representa solo el 0,22% de los átomos de la corteza terrestre. Esto está muy lejos del oxígeno (47%) y el silicio (27%). Su presencia tampoco es considerable en la atmósfera terrestre, pues este elemento representa solamente 0,55 ppm de los gases atmosféricos en términos de volumen.

El hidrógeno está clasificado en primer lugar en la tabla de clasificación periódica de los elementos y por lo tanto tiene el número atómico 1. Su isótopo es el más simple, ya que posee un núcleo dotado de un solo protón (carga eléctrica positiva), pero desprovisto de neutrón (carga eléctrica neutra). Por otra parte, el hidrógeno dispone de un electrón alrededor de este núcleo, el componente elemental que lleva la carga eléctrica negativa de la materia. Así, el hecho de poseer un solo electrón lo hace un átomo univalente. Esto implica que puede formar únicamente enlaces covalentes.
El hidrógeno es un gas extremadamente ligero, transparente e inodoro. Su masa atómica estándar es de 1,00794 u, su masa molar es de 1,01 g/mol y su densidad es de 0,0899 kg/m3. Aunque es muy inflamable, no es corrosivo ni tóxico.
Bajo una presión intensa, el hidrógeno sólido puede ser metálico. Este elemento cristaliza con un enlace metálico. Así, está situado en la columna de los metales alcalinos en la tabla periódica de los elementos. Sin embargo, no está reconocido como metal en el campo de la química dado que no está presente en este estado en la Tierra.
La sección eficaz de captura del hidrógeno es de 0,04 mb para neutrones rápidos y de 200 mb para neutrones térmicos. Esto es suficientemente bajo, de ahí el uso del agua como elemento refrigerante y moderador (sustancia que ralentiza los neutrones, sin por ello absorberlos) de los reactores nucleares.
Como el hidrógeno constituye el más simple de los átomos, permite la resolución más simple de la ecuación de Schrödinger en mecánica cuántica. Este estudio es esencial, ya que ha conducido a la explicación de los orbitales atómicos, y luego a la de los diferentes enlaces químicos con la teoría de los orbitales moleculares.
Por definición, los isótopos son nucleidos que tienen el mismo número atómico, pero un número de neutrones diferente. El hidrógeno es el único que tiene nombres y símbolos diferentes para cada uno de sus isótopos. Se encuentran esencialmente tres isótopos naturales de este elemento, especialmente el protio, el deuterio y el tritio. Los otros, entre los más conocidos están el cuadrio y el hidrógeno 7, han sido sintetizados en laboratorio.
También llamado 1H o hidrógeno ligero. El protio es un isótopo estable con una abundancia de aproximadamente 99,98%. Su núcleo atómico está constituido por un solo protón y ningún neutrón.
También llamado 2H o D, el deuterio es mucho menos abundante (entre 0,0026 y 0,0184% del hidrógeno natural). Su núcleo contiene un neutrón y un protón. También constituye un isótopo estable. No radiactivo, no presenta ningún peligro en términos de toxicidad. Por otra parte, se llama “agua pesada” al agua enriquecida en moléculas que contienen 2H en lugar de átomos “normales” de hidrógeno.
Este isótopo, cuyo núcleo posee un protón y dos neutrones, también es conocido con el nombre de 3H o T. Este elemento raro tiene una vida media de 12,32 años. Radiactivo, se transforma en helio 3 (3He) por desintegración β−. Al igual que el 2H, puede participar en reacciones de fusión nuclear. Así, se utiliza en armas termonucleares y en ciertos dispositivos de iluminación autoalimentados. Sin embargo, su radiotoxicidad es muy débil cuando se presenta en forma HTO (agua pesada o agua tritiada).
En el medio natural, el 3H tiene la capacidad de tomar el lugar del 1H. Esto afecta a las moléculas biológicas, hasta en el ADN donde este elemento puede ser el origen de una apoptosis celular o de una ruptura de la información genética.
También llamado tetradio 4H o Q, el cuadrio es el isótopo más inestable del hidrógeno. Tiene una vida media de 1,39 x 10-22 segundos. Su núcleo posee un protón y tres neutrones. Sintetizado en laboratorio, este elemento es el resultado del bombardeo de un 3H con núcleos rápidos de 2H. Se transforma por emisión de neutrón.
Este isótopo es el más rico en neutrones que existe, ya que posee cuatro. Sin embargo, tiene la vida media más corta conocida, es decir, 10-21 segundos.
Presente en gran cantidad en el corazón de las estrellas, el hidrógeno constituye una fuente de energía que contribuye a las reacciones de fusión nuclear. Estas últimas combinan dos núcleos de átomos de hidrógeno para formar helio. Esta fusión nuclear se efectúa por la cadena PP (protón-protón) de Arthur Stanley Eddington y el ciclo carbono-nitrógeno-oxígeno catalítico de Carl Friedrich von Weizsäcker y Hans Albrecht Bethe.
En las bombas H o bombas de hidrógeno, la fusión nuclear concierne a isótopos intermedios como el tritio. Es idéntica a la fusión que tiene lugar en las estrellas. Sin embargo, en este tipo de bomba, las reacciones nucleares duran solamente unas decenas de nanosegundos. Así, la reacción se efectúa en una sola etapa. Ahora bien, varias etapas son necesarias para transformar el hidrógeno en helio. De hecho, la primera etapa, que es la reacción de un protón, es muy lenta.
El hidrógeno es el cuerpo simple más ligero. Está formado por moléculas H2, salvo bajo una presión extremadamente alta (como es el caso en las partes centrales de Saturno y Júpiter). En este caso, el hidrógeno está en un estado “oscuro”, ya que se sitúa entre el metal y el gas. También se encuentra la excepción en un entorno con presiones extremadamente bajas, como en el espacio intergaláctico. Por otra parte, el hidrógeno no refleja ni transmite la luz, lo que hace de este elemento un débil conductor de electricidad.
El hidrógeno molecular existe en dos formas alotrópicas generalmente llamadas isómeros de espín nuclear. Se cita el ortohidrógeno (con dos espines nucleares alineados paralelamente) y el parahidrógeno (con dos espines de protones antiparalelos).
La forma de almacenamiento más común del hidrógeno es el gas. Este gas molecular de fórmula H2 se presenta bajo esta forma en condiciones normales de presión y temperatura. Representa cerca del 75% de la masa bariónica del Universo aunque es de muy baja densidad. Se califica de gas interestelar e intergaláctico, ya que es monoatómico, ya sea a muy baja presión o a muy alta temperatura.

Este tipo de hidrógeno es el dihidrógeno enfriado por debajo de su punto de condensación, es decir, -252,87 °C a presión atmosférica (101.325 Pa). Su densidad es de 70,978 kg/m3. En este estado, el hidrógeno es a menudo designado por el acrónimo LH2 en el campo astronáutico. Es uno de los combustibles líquidos más utilizados en el despegue. Tal es el caso para el lanzador Ariane 5, el transbordador espacial americano, y el lanzador Delta IV.
El hidrógeno se vuelve sólido cuando su temperatura baja por debajo de su punto de fusión, especialmente a -259,14 °C. Este descubrimiento fue realizado por el químico y físico británico Sir James Dewar en 1899.
El hidrógeno se vuelve metálico cuando está sometido a temperaturas muy bajas y a una presión muy fuerte. Constituye así una materia degenerada, es decir, una materia de densidad suficientemente elevada que permite al principio de exclusión de Pauli intervenir a escala macroscópica.
De fórmula H3, constituye una forma alotrópica muy inestable del hidrógeno.

El hidrógeno puede formar enlaces covalentes así como compuestos cuando interactúa con otros elementos.
Cuando el átomo de hidrógeno pierde su único electrón, se convierte en un ion H+ y toma la denominación de “protón”. En este caso, el elemento se reduce a su núcleo. Si esto ocurre al isótopo más abundante, especialmente el protio, la denominación más correcta es hidrón. Esta materia de tamaño muy pequeño posee un radio de aproximadamente 1,5 x 10-15 m, mientras que el átomo de hidrógeno mide 5 x 10-11 m.
Si el hidrógeno es líquido, el protón no existe en estado libre ya que está siempre unido a la nube electrónica de una molécula. En solución acuosa, está solvatado por moléculas de agua. Esto provoca la formación del ion H3O+ llamado hidronio, hidroxonio o también oxonio.
También ocurre que el átomo de hidrógeno adquiere un segundo electrón y forma el ion hidruro H–. En este caso, posee un cortejo electrónico estable idéntico al del helio.
Teniendo una electronegatividad media de 2,2, el hidrógeno puede formar compuestos con elementos no metálicos y metálicos. Así puede combinarse con la mayoría de los otros elementos de la tabla de Mendeleev. Se llaman “hidruros” a los compuestos formados por el hidrógeno y los metales. Se encontrará en forma de ion H–, y esto, a menudo en solución. El hidrógeno forma enlaces covalentes en los compuestos formados con los elementos no metálicos, ya que el ion H+ tiende generalmente a asociarse con los electrones. Por otra parte, forma iones H3O+ cuando asocia su protón a una molécula de agua.
El enlace covalente es un enlace químico en el cual dos átomos forman un par de electrones que los une. Este fenómeno ocurre cuando estos átomos comparten dos electrones de una de sus capas externas respectivas. En cuanto al hidrógeno, puede comprometer su único electrón con varios átomos no metálicos. Los compuestos más encontrados son la molécula de agua H2O, la molécula de dihidrógeno H2 y la molécula de hidrocarburo CxHy.
El hidrógeno también puede estar unido a átomos de nitrógeno, oxígeno y carbono, lo que le permite estar presente en todas las moléculas orgánicas.
El enlace de hidrógeno también es llamado puente de hidrógeno. Constituye una interacción electrostática entre un átomo de hidrógeno y un átomo electronegativo como el flúor (F), el nitrógeno (N) y el oxígeno (O). El hidrógeno ocupa así un lugar importante en química orgánica. También juega un papel primordial en química inorgánica, ya que puede interactuar con los alcoholes y los alcoholatos metálicos.
El hidrógeno interviene en una reacción ácido-base según la teoría de Brønsted-Lowry. Juega un papel importante, ya que esta última hace referencia concretamente al intercambio de un ion de hidrógeno H+ entre dos especies. Se trata especialmente del ácido que libera el H+ por ruptura del enlace covalente así como de la base que lo capta por formación de un nuevo enlace. Aquí está la ecuación correspondiente:
AH + B = A– + BH+
Ácido 1 Base 2 Base 1 Ácido 2
a partir de 49€
![]()
Hecho en España
Disponible, 7 días a la semana
Dentro de 14 días, satisfecho o reembolsado
PayPal, tarjeta de crédito, Visa, Mastercard, transferencia bancaria
4x sin intereses desde 30€ de compra con PayPal