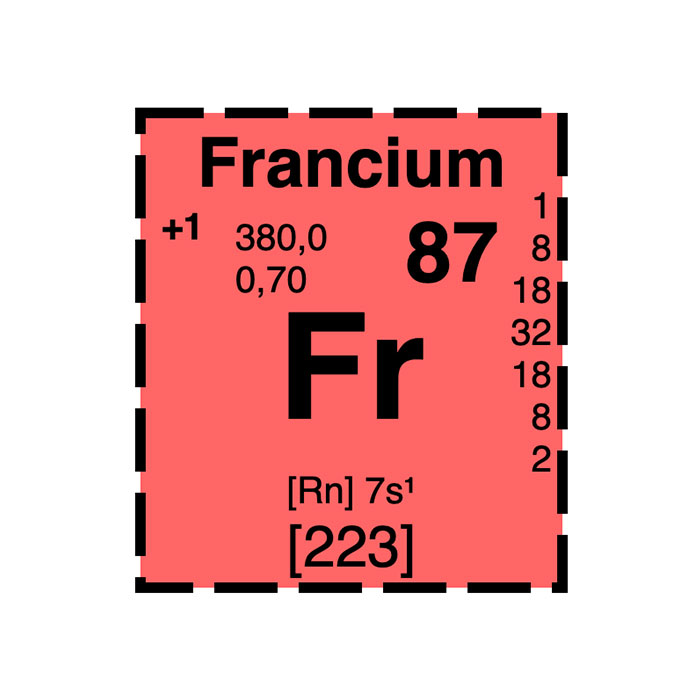
Características del francio
- Símbolo: Fr
- Masa atómica: 223 u
- Número CAS: 7440-73-5
- Configuración electrónica: [Rn]7s1
- Número atómico: 87
- Grupo: 1
- Bloque: Bloque s
- Familia de elementos: Metal alcalino
- Electronegatividad: 0,7
- Punto de fusión: 27 °C
NAVIDAD : ¡ Hasta un 50 % de descuento en todo el sitio ! + Regalo sorpresa ! + Sorteo del 01/12 al 25/12: ¡3 Cúmulo de Cuarzo en juego! |

Conocido como actinio K y eka-cesio, el francio es el elemento químico de símbolo Fr y número atómico 87. Pertenece a la familia de los metales alcalinos. Su descubrimiento por Marguerite Perey data de 1939, cuando procedió a la purificación del lantano que contenía actinio. Eligió el nombre “francio” en homenaje a Francia. Todos los isótopos del Fr son radiactivos y tienen una vida media muy corta. Este elemento se presenta como un radioelemento, con solo algunas aplicaciones conocidas.
El francio se sitúa en el 7º período y pertenece al bloque s de la tabla periódica de los elementos. Su configuración electrónica es [Rn]7s1 y posee 2 electrones en el primer nivel de energía, seguido de 8, 18, 32, 18, 8, y un electrón en los niveles de energía siguientes. A diferencia de ciertos elementos, especialmente el tecnecio, este elemento fue el último en ser descubierto en la naturaleza, antes de ser sintetizado. Entre los 92 constituyentes de la clasificación periódica, forma parte de los elementos raros. De hecho, solo existen unos treinta gramos en la corteza terrestre. Esta rareza proviene de su existencia transitoria como producto de desintegración del actinio.

Desde la década de 1870, la comunidad de químicos preveía la existencia de un metal alcalino de número atómico 87, que debía encontrarse lógicamente debajo del cesio en la clasificación periódica. En aquella época, se le designó provisionalmente con el nombre de eka-cesio. Los equipos de investigadores intentaron detectar este elemento faltante antes de aislarlo. Se publicaron al menos cuatro declaraciones prematuras sobre su descubrimiento antes de que fuera realmente identificado.
En 1925, el químico ruso D.K. Dobroserdov fue el primero en anunciar el presunto descubrimiento del eka-cesio, después de detectar trazas de radiactividad en una muestra de potasio. Concluyó que la muestra había sido contaminada por el eka-cesio. Entonces publicó una tesis exponiendo las posibles propiedades de este elemento, al que nombró russium, en referencia a su país de origen. Sin embargo, abandonó sus investigaciones para concentrarse en su carrera docente en el Instituto Politécnico de Odessa.
Al año siguiente, los químicos ingleses Frederick H.Loring y Gérald J.F. Druce estudiaron imágenes de rayos X del sulfato de manganeso y observaron líneas espectrales que atribuyeron al eka-cesio. Estos químicos anunciaron entonces su descubrimiento del elemento 87. Propusieron el nombre alkalinium, considerando que sería el metal alcalino más pesado.
En 1930, el profesor Fred Allison, del Instituto Politécnico de Alabama, declaró haber descubierto el francio estudiando el efecto magneto-óptico en muestras de lepidolita y polucita. Propuso el nombre de virginium, por el nombre de su estado natal, y sugirió los símbolos Vi y Vm.
En 1934, MacPherson, profesor de la Universidad de California en Berkeley, refutó este descubrimiento demostrando errores debidos a problemas de equipamiento.
En 1936, Horia Hulubei, físico rumano, y su colega francesa Yvette Cauchois realizaron un estudio exhaustivo de la polucita, utilizando un aparato de espectroscopia de rayos X de alta resolución. Sus observaciones revelaron varios rayos de emisión de baja intensidad que identificaron como pertenecientes al elemento 87. Publicaron sus resultados y propusieron nombrar este elemento moldavium, con el símbolo Ml, en referencia a Moldavia, provincia natal de Hulubei.
En 1937, el físico estadounidense F.H.Hirsh Jr. cuestionó los trabajos de Hulubei y rechazó sus métodos. Según Hirsh, el eka-cesio no existía en la naturaleza y las líneas espectrales enunciadas por Hulubei eran en realidad las del mercurio o del bismuto. Sin embargo, este último contestó estas críticas. Afirmó que sus equipos y sus métodos eran precisos y que tal confusión era imposible. A pesar de ello, Jean Baptiste Perrin, el mentor de Hulubei y laureado con el premio Nobel de física, sostuvo que el moldavium era el verdadero eka-cesio y lo atestiguó. Ignoró el descubrimiento del francio por Marguerite Perey. Hasta que se le atribuyó el descubrimiento del elemento 87, Perey no dejó de impugnar los trabajos de Hulubei.
El verdadero eka-cesio francio fue descubierto por Marguerite Perey en 1939, en el Instituto Curie de París, mientras realizaba trabajos de purificación en una muestra de actinio 227. Este elemento posee una energía de desintegración de 220 keV. Observó que se emitían partículas con una energía inferior a 80 keV y sospechó la existencia de un producto de desintegración desconocido. Lo consideró como la causa de este decaimiento radiactivo. Este producto desaparecería durante la purificación y reaparecería durante la desintegración de núcleos de actinio. Sus pruebas excluyeron la presencia de torio, radio, plomo, bismuto y talio. Las propiedades químicas del nuevo producto resultaron similares a las de un metal alcalino, especialmente su coprecipitación con sales de cesio. Este descubrimiento llevó a Perey a concluir que se trataba del elemento 87, resultado de la desintegración α del actinio 227. Entonces emprendió análisis para determinar la proporción de desintegración α y β del 227Ac. Sus primeras pruebas le permitieron evaluar la tasa de desintegración alfa en 0,6%, que revisó al 1%. Perey nombró al nuevo isótopo actinio-K, que era el actual francio 223.
En 1946, propuso nombrar al nuevo elemento catium, porque sabía que este elemento es el más electropositivo de la clasificación periódica. Sin embargo, Irène Joliot-Curie, su superiora, se opuso, debido a su similitud con la palabra “cat” en inglés, que significa gato. Entonces, en homenaje al país de su descubrimiento, Perey propuso la denominación francio.
En 1949, la Unión Internacional de Químicos adoptó oficialmente el nombre de francio y el símbolo Fa, cambiado posteriormente a Fr. Después del descubrimiento del renio en 1925, el francio fue el último elemento existente en ser revelado. Se realizaron investigaciones sobre esta sustancia desde ese momento, particularmente las de Sylvain Lieberman y su equipo en el CERN en los años 1970 y 1980.
El francio 223, con una vida media inferior a 22 minutos, es el radioisótopo del francio más estable. Todos sus isótopos se disocian formando astato, radón o radio.
Esta tabla proporciona información sobre las propiedades radiactivas de diferentes isótopos del francio.
| Iso | AN | Período | MD | Ed | Pd |
| 221Fr | trazas | 4,54 min | α | 6,457 | 217At |
| 222Fr | {sin.} | 14,24 min | β– | 1,78 | 222Ra |
| 223Fr | 100 % | 21,48 min | β– α | 1,12 5,340 | 223Ra 219At |
Los isótopos se presentan en la primera columna, con su símbolo químico y su número de masa.
La columna de la abundancia natural contiene las duraciones de vida media y la información sobre la presencia de trazas de isótopos.
El período representa el tiempo que tarda un isótopo en desintegrarse a la mitad (vida media), emitiendo partículas radiactivas.
Los modos de desintegración se presentan en la tercera columna. Una desintegración beta implica la emisión de un electrón o un positrón, mientras que una desintegración alfa implica la producción de un núcleo de helio.
Los productos de desintegración son los isótopos que se obtienen después de la desintegración del isótopo inicial.
Ejemplo
El isótopo más estable 223Fr tiene una vida media de 22 minutos, antes de transformarse en astato por radiación alfa, o en radio por desintegración beta. Esta doble radiactividad hace que el astato sea aún más raro que el Fr, aunque el 210At tiene una vida media superior (8,1 horas) a la del francio 223. Sin embargo, el torio y el uranio también producen At. Por consiguiente, su rareza tiene poca relación con la del elemento 87.
La desintegración alfa menos descompone el francio en radio 223, en casi su totalidad (99,994%). Por el mismo proceso, el resto 0,006% produce 219At. Este último, de período 56 segundos, contribuye débilmente al astato total mayoritariamente compuesto de 210At de período 8,1h.
Por desintegración alfa, el 223Ra (período de 11,43 días) produce 219Rn (período 3,96 s) que, en el mismo proceso, proporciona polonio 215 (período 1,78×10−3 s). Por desintegración alfa, 99,99% de este elemento se transforma en 211Pb (período 36,1 min) que, a su vez, se desintegra en bismuto 211 (período 2,15 min). El talio 207 (período 4,78 min) proviene de la desintegración del 211Bi, sin pasar por el astato. Solo 0,01% de las descomposiciones del 215Po produce 215At (período 10−4 s). Por consiguiente, su contribución al astato total es también muy débil. Estos elementos confirman que la contribución del 223Fr a la presencia de astato en la Tierra es mínima.

Entre los elementos más ligeros que el seaborgio, de número atómico 106, el francio es el menos estable.
El elemento químico francio, con una masa atómica de [223 u] y un radio de covalencia de 260 pm, posee un radio de van der Waals de 348 pm. Su átomo presenta un estado de oxidación +1. La basicidad de un óxido depende de la naturaleza del elemento metálico y de su grado de oxidación. Cuanto más electronegativo sea el elemento metálico, más básico será el óxido. El Fr es a la vez reactivo y electronegativo, lo que sugiere que su óxido también sería básico si fuera sintetizado u observado. Su energía de ionización se eleva a 4,072 741 eV.
El francio, en estado ordinario, se presenta en forma sólida y no es magnético. Su densidad es de 1.870 kg·m-3. Se piensa que su estructura cristalina es cúbica centrada. Se funde a una temperatura de 27 °C y hierve a 676,85 °C. El Fr presenta una conductividad eléctrica superior a 3×106 S·m-1 y una conductividad térmica de 15 W·m-1·K-1.
Las características químicas del francio se asemejan a las del cesio. Como elemento pesado con un único electrón de valencia, posee la mayor masa atómica equivalente. También, su electronegatividad es la más baja en la escala de Pauling con 0,7, seguido de cerca por el cesio con 0,79. Si se lograra obtener Fr en estado líquido, su tensión superficial a la temperatura de fusión sería de 0,050 92 J m−2. Una tensión que es relativamente baja.
El francio coprecipita con numerosas sales de cesio tales como el yodato, el picrato, el tartrato (y el tartrato de rubidio), el cloroplatinato y el silicotungstato. Con el perclorato de cesio, forma pequeñas cantidades de perclorato de francio. Se puede aplicar el método de coprecipitación del cesio de Nelson y Glendenin para aislar el Fr. Otras técnicas de separación pueden utilizarse precipitando el francio con ácido perclórico y ácido silicotúngstico. Gran parte de las sales de francio se disuelve en agua.
Debido a su rareza y a su carácter inestable, el francio no encuentra ninguna aplicación comercial. Su uso se limita a la investigación en el campo de la biología y en el de la física atómica. Aunque se había considerado como una ayuda potencial para diagnosticar enfermedades cancerosas, su aplicación en esta vía resultó imposible.
Su estructura atómica simple sumada a la posibilidad de sintetizarlo, confinarlo y enfriarlo hace del francio un objeto de estudio para experimentos de espectroscopia. Se han obtenido así informaciones sobre los niveles de energía y las constantes de acoplamiento entre partículas subatómicas. Los iones de 210Fr confinados por láser emiten radiaciones. Su estudio ha permitido obtener datos exactos sobre las transiciones entre los niveles de energía atómicos. Los resultados de los experimentos se aproximan a los predichos por la física cuántica.
El francio se genera por la desintegración alfa de 227Ac y se encuentra en estado de trazas en los minerales de torio y uranio. En una muestra dada de uranio, se estima que hay un átomo de Fr por 10 átomos de uranio. Además, según los cálculos, solo 30 g de francio existirían permanentemente en la corteza terrestre. Por lo tanto, el elemento 86 es el segundo elemento más raro, después del astato.
La reacción nuclear 197Au + 18O → 210Fr + 5n describe la producción del francio, siguiendo el método de síntesis desarrollado en la Universidad Estatal de Nueva York. Permite generar los isótopos de masas atómicas 209, 210 y 211, y luego aislarlos utilizando un efecto magneto-óptico. Más de mil átomos de Fr han sido así almacenados juntos durante aproximadamente veinte segundos.
Además, el francio también ha sido producido en una trampa magneto-óptica en Legnaro, Italia, en el laboratorio LNL del INFN. Entre otros procesos de síntesis figuran el bombardeo de átomos de radio con neutrones, así como el bombardeo de átomos de torio con protones, deuterio o helio ionizado. Sin embargo, hasta la fecha, su producción a gran escala nunca se ha realizado.
a partir de 49€
![]()
Hecho en España
Disponible, 7 días a la semana
Dentro de 14 días, satisfecho o reembolsado
PayPal, tarjeta de crédito, Visa, Mastercard, transferencia bancaria
4x sin intereses desde 30€ de compra con PayPal