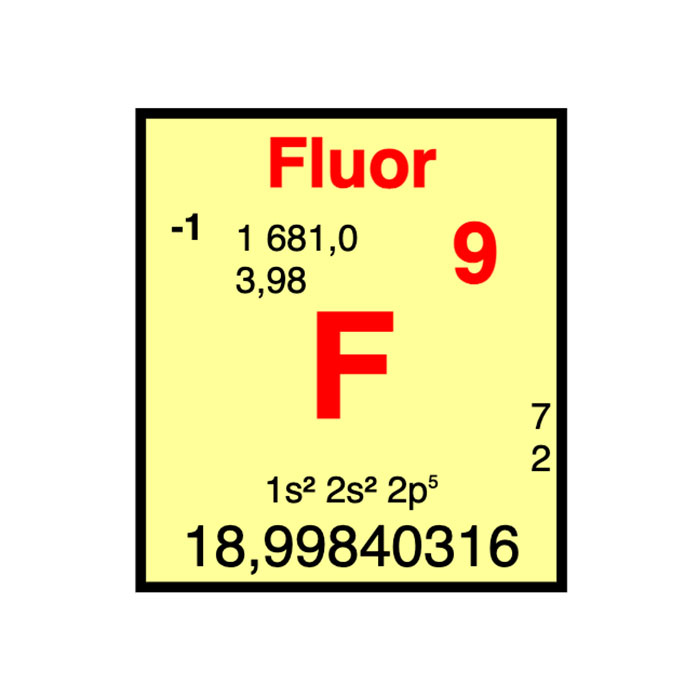
Características del flúor
- Símbolo: F
- Masa atómica: 18,998 403 163 ± 0,6 × 10−9u1
- Número CAS: 14762-94-85
- Configuración electrónica: [He]2s2 2p5
- Número atómico: 9
- Grupo: 17
- Bloque: Bloque P
- Familia de elementos: Halógeno
- Electronegatividad: 3,98
- Punto de fusión: -219,67 °C


