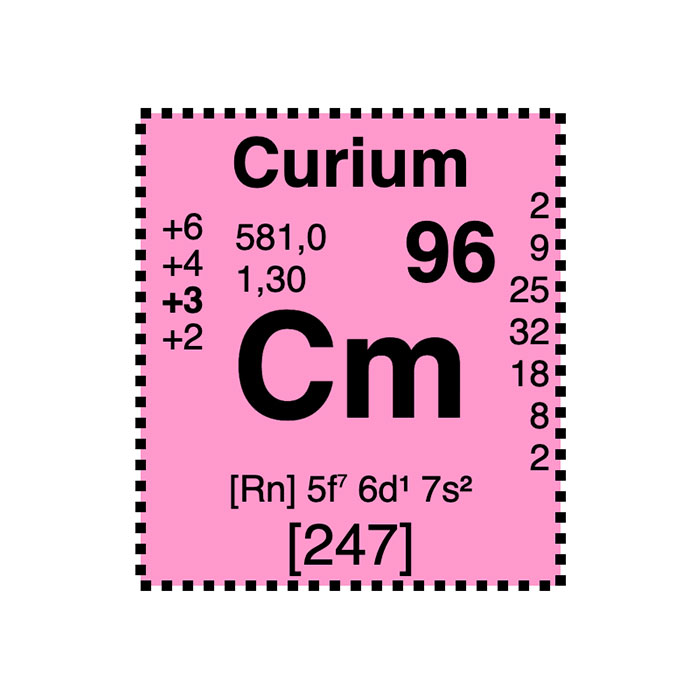
Características del Curio
- Símbolo: Cm
- Masa atómica: 247 u
- Número CAS: 7440-51-9
- Configuración electrónica: [Rn] 5f7 7s2
- Número atómico: 96
- Grupo: –
- Bloque: Bloque f
- Familia de elementos: Actínido
- Electronegatividad: 1,3
- Punto de fusión: 1 345 °C
NAVIDAD : ¡ Hasta un 50 % de descuento en todo el sitio ! + Regalo sorpresa ! + Sorteo del 01/12 al 25/12: ¡3 Cúmulo de Cuarzo en juego! |

De número atómico 96, el curio es el elemento de símbolo Cm. Forma parte de los actínidos. También es un elemento sintético transuránico. Su nombre hace referencia a Pierre y Marie Curie.
Este metal radiactivo es de color blanco plateado. Es muy duro. Su formación ocurre en los reactores nucleares. Se encuentran aproximadamente 20 g del elemento 96 en una tonelada de combustible usado.
En el verano de 1944, el curio fue sintetizado a partir del plutonio. Este último es un elemento más ligero. Este experimento primero se mantuvo oculto a los ojos de todos. Un año después, Glenn T. Seaborg anunció públicamente el descubrimiento del elemento 96 durante un programa para niños en un medio estadounidense. Como invitado, respondió a un joven oyente que preguntó sobre el descubrimiento de nuevos elementos. El elemento 96 emite abundantemente partículas α. Esta propiedad le confiere una gran potencia térmica. Por ello, los generadores termoeléctricos de radioisótopos lo probaron como fuente de calor. También tiene una aplicación en la formación del plutonio 238. Este último sirve como activador de marcapasos. También puede ser utilizado en los generadores de radioisótopos de baja radiactividad γ. El curio es la materia prima de otros transactínidos y transuránicos. Se utiliza como fuente de rayos α en los espectrómetros de rayos X. Estos espectrómetros permitieron el análisis de la superficie del cometa 67P/Churyumov-Gerasimenko por la sonda Philae de la misión Rosetta. También ayudaron al análisis de las rocas en Marte por los robots Spirit, Sojourner y Opportunity.

El año 1944 marca el descubrimiento del curio por Glenn T. Seaborg, Albert Ghiorso y Ralph A. James. Su serie de investigaciones se llevó a cabo en la Universidad de California en Berkeley con un ciclotrón de 1,50 m. El elemento 96 es el tercer transuránico descubierto desde 1940, después del neptunio y el plutonio. La elaboración del curio se logró antes que la del americio. Sin embargo, este último tiene un número atómico inferior en una unidad.
Los óxidos del elemento a irradiar sirven como materias primas para la elaboración de un nuevo elemento. Para el elemento 96, se extiende nitrato de 239Pu sobre una hoja de platino de 0,5 cm². Después de la evaporación de la solución, el calentamiento de la sal restante conduce al dióxido de plutonio. Sigue una exposición en el ciclotrón, una disolución por ácido nítrico y una precipitación por una mezcla amoniacal. El siguiente paso consiste en disolver el resto con ácido perclórico. Los intercambiadores iónicos ayudan a la separación final. Estas investigaciones llevaron a la producción de 242Cm y 240Cm.
En agosto de 1944, la irradiación de plutonio 239 con partículas α da como resultado curio 242:
23994Pu + 42He → 24296Cm + 10n.
La energía de la partícula α emitida en la desintegración facilita la identificación del isótopo:
24296Cm → 23894Pu + 42He.
Esta desintegración tenía una vida media de 150 días. Actualmente, la mejor medida es de 162,8 días.
En marzo de 1945, el mismo grupo de científicos descubre el 240Cm. El principio es el mismo que el del 242Cm: 239Pu irradiado por partículas α.
23994Pu + 42He → 24096Cm + 310n.
Esta desintegración tenía una vida media de 27,6 días. Actualmente, la medida es de 27 días.
Estando en plena Segunda Guerra Mundial, la identificación del curio no se reveló inmediatamente. El 11 de noviembre de 1945, Glenn Seaborg participó en el programa de radio estadounidense Quiz Kids. Un joven oyente preguntó sobre el descubrimiento de nuevos elementos durante la investigación de armas químicas. El científico anunció la identificación del curio y del americio. Esta declaración precede al anuncio oficial en un coloquio de la American Chemical Society.
Posteriormente, el descubrimiento del elemento, sus isótopos y sus compuestos fue acreditado a Glen Seaborg. Esta serie de investigaciones se denominó “ELEMENT 96 AND COMPOSITIONS THEREOF”
La nomenclatura del elemento 96 corresponde a la del gadolinio. Este último se encuentra justo encima del curio en la tabla periódica de los elementos. Sus siete electrones 4f también son análogos a los 7 electrones 5f del elemento 96. El término curio hace referencia a los célebres físicos Pierre y Marie Curie. En efecto, sus trabajos condujeron a la investigación sobre la radiactividad. Por su parte, el gadolinio fue nombrado en honor al célebre científico Johan Gadolin.
En 1947, Louis Werner e Isadore Perlman crearon la primera cantidad ponderal de curio. Está en forma de hidróxido de curio. El principio del proceso es la irradiación neutrónica de 241Am. El resultado produjo 40 µg de 242Cm(OH)3. En 1951, el bario redujo el curio a CmF3.

En 2016, un estudio demostró que al principio el sistema solar contenía curio. Un meteorito que contenía uranio 235, que es un producto de descomposición del curio 247, permitió confirmar esta hipótesis.
El isótopo con el período de vida más largo es el 247Cm. Solo alcanza los 15,6 × 106 años. Por lo tanto, el curio terrestre inicial se ha desintegrado. La investigación utiliza pequeñas cantidades de curio sintetizado. Los combustibles usados de los reactores nucleares también contienen una cantidad ínfima del elemento 96.
Hasta 1980, el curio ambiental deriva de las pruebas de bombas atómicas atmosféricas. Los residuos nucleares y otras pruebas atómicas han aumentado la concentración de curio local. Esto influye muy poco en la radiactividad natural.
El 1 de noviembre de 1952, se exploraron los desechos de Ivy Mike, la primera bomba H estadounidense. Estos restos en el atolón de Enewetak permitieron la identificación de varios elementos:
Ese día marcó el descubrimiento del 245Cm y del 246Cm. También se evidenciaron pequeñas cantidades de 247Cm, 248Cm y trazas de 249Cm.
Estos resultados no se publicaron hasta cuatro años después, debido a su cobertura por el secreto militar.
Los reactores nucleares son el lugar de formación de pequeñas cantidades de curio. Las existencias mundiales son de solo unos pocos kg. El precio del 244Cm o del 248Cm es muy costoso, ascendiendo a aproximadamente 160 USD/mg. Una serie de reacciones nucleares ocurre en los reactores a partir del 238U. La captura neutrónica es una etapa importante de la formación. El nucleido excitado se desintegra por radiación γ y se convierte en su forma básica. Las fisiones de otros núcleos del reactor crean los neutrones libres. Siguen dos desintegraciones β- y la producción de 239Pu. Esta reacción es el origen de nuevos materiales fisibles en los reactores regeneradores.
23892U (n,γ) → 23992U β– → 23993Np β- → 23994Pu.
La desintegración del uranio 239 en neptunio 239 dura 23,5 minutos. A partir de esta etapa, el neptunio 239 se desintegra durante 2,25 días en plutonio 239.
Dos capturas neutrónicas y una desintegración β– forman el americio 241. Este último sufre otra captura neutrónica y una desintegración β– para dar el curio 242:
23994Pu 2(n,γ) → 24194Pu β- → 24195Am (n,γ) → 24295Am β- → 24296Cm
La desintegración del 241Pu en 241Am dura 14,35 años y el 242Am en 242Cm 16,02 h.
Otra forma de producir curio comienza con el plutonio obtenido a partir de combustibles nucleares usados. Este plutonio será irradiado por un flujo elevado de fuentes de neutrones. Otra cadena de reacción puede predominar si el flujo aumenta.
Más precisamente, el plutonio 239 se transforma por cuatro capturadores neutrónicos sucesivos en 243Pu. Este último sufre una desintegración β– durante 4,96 h para dar americio 243. El isótopo sufre luego una nueva captura neutrónica y forma el americio 244. Sigue una desintegración β– de 10,1 h. El resultado final de la serie es el 244Cm.
23994Pu 4(n,γ) → 24394Pu β- →24395Am (n,γ) → 24495Am β- → 24496Cm α → 24094Pu.
Dado que esta reacción ocurre en los reactores nucleares, el 244Cm se encuentra en los productos de reprocesamiento de combustibles nucleares.
Se producen isótopos pesados en el reactor a partir del 244Cm. Debido a su larga vida útil, el 247Cm y el 248Cm son muy solicitados en las investigaciones.
A96Cm + 10n → A+196Cm + γ
La corta vida útil del 249Cm desfavorece la producción de 250Cm. Disminuye la posibilidad de captura neutrónica. La desintegración α del californio 254 produce curio 250. Sin embargo, el 254Cf se desintegra principalmente por fisión espontánea y rara vez por desintegración α.
El curio producido es una mezcla de varios isótopos. Esto se debe a una serie de desintegraciones β- y capturas neutrónicas. Su fragmentación es particularmente difícil.
El 248Cm se utiliza mucho en los experimentos, porque tiene una larga vida. La desintegración alfa del californio 252 es el proceso más seguro para producir el isótopo. Dura 2,645 años. Debido a su larga vida, el 252Cf se obtiene en gran cantidad. La pureza isotópica del curio 248 obtenido es del 97%. Su producción anual es del orden de 35 a 50 mg.
25298Cfα → 24896Cm
La desintegración β– del berkelio 249 produce una ínfima cantidad de californio 249. La desintegración de este último durante 351 años produce el curio 245.
24997Bkβ- → 24998Cfα → 24596Cm
La reducción de los compuestos forma el curio metálico. El primer paso consiste en reducir el fluoruro de curio. En un aparato de tungsteno o tántalo, el fluoruro reacciona con litio o bario en ausencia de oxígeno o agua.
CmF3 + 3 Li → Cm + 3 LiF
El curio metálico también puede obtenerse por reducción de dióxido de curio. Se hace por aleación de zinc y magnesio en un flujo de fluoruro de magnesio y cloruro de magnesio.
Este metal artificial es radiactivo y duro. Su aspecto imita al gadolinio. Por lo tanto, es de color blanco plateado. Sus otras propiedades físico-químicas se asemejan a su análogo de los lantánidos. Comparado con los transuránicos descubiertos posteriormente, el curio tiene un punto de fusión más elevado. Se eleva a 1.340 °C mientras que el del americio es de 1.173 °C, el plutonio 639 °C, el neptunio 637 °C. Sometido a una temperatura de 1.312 °C, el gadolinio funde. A 3.110 °C, el curio está en ebullición.
En condiciones normales de temperatura y presión, solo se observa una estructura cristalina, el Cm-α. Su red es hexagonal del grupo P63/mmc. La configuración de la red es de 4 átomos por célula elemental, a= 365 pm y c= 1.182 pm. Un doble apilamiento hexagonal compacto y una sucesión de capas tipo ABAC constituyen la estructura. Esta forma es isotópica a la de la estructura α del lantano.
Sometido a una presión superior a 23 GPa, el Cm-α se convierte en Cm-β. Este último es de estructura cúbica del grupo Fm3m. La red cúbica está centrada en las caras compactas provistas de una serie de capas ABC. El parámetro de red es a= 493 pm.
La espectroscopía de fluorescencia láser resuelta en tiempo estudia la fluorescencia de los iones Cm estimulados. Esta fluorescencia es lo suficientemente larga para ser explotada. La enorme distancia entre el primer estado excitado 6D7/2 y el fundamental 8S7/2 explica esta larga fluorescencia. Esto es útil en la selección de compuestos de curio en un lote importante. En efecto, la fluorescencia de otros iones metálicos o de sustancias orgánicas es más corta.
El número de oxidación más estable del curio es +3: Cm2O3 y Cm(OH)3. A veces, puede encontrarse en el grado de oxidación +4: CmO2. La química del curio imita a los lantánidos y al americio. El Cm3+ es incoloro y el Cm4+ es amarillo pálido en solución acuosa.
Los iones curio pertenecen a los ácidos fuertes de Lewis. Construye los complejos más estables con bases fuertes. La elaboración de los complejos se basa en las interacciones iónicas y solo posee un componente covalente. El proceso de complejación del curio imita más a los lantánidos que a los actínidos como el torio y el uranio. Una coordinación de nueve elementos geométricamente de tres prismas de tres lados yuxtapuestos es privilegiada por el curio.
Excepto por su carácter radiactivo, el curio no tiene poder biológico específico. Investigadores han estudiado la absorción de Cm3+ por arqueas y bacterias.
Debido a su alta sección eficaz, 243Cm, 245Cm y 247Cm tienen su uso como combustibles para reactores térmicos. Los isótopos de 242Cm a 248Cm y 250Cm aseguran una reacción en cadena. Algunos lo hacen solo con neutrones rápidos. En un reactor regenerador rápido, los combustibles pueden formarse por cualquier combinación de estos isótopos. El beneficio reside en el reprocesamiento de combustible usado. Una separación química es suficiente en lugar de hacer una separación isotópica.
La tabla a continuación muestra las masas críticas para un círculo desprovisto de moderador y de reflector, luego provisto de reflector y finalmente de ambos.
| Isótopo | Masa crítica | Radio | + reflector | + moderador + reflector |
| 242Cm | 371 kg | 40,1cm | ||
| 243Cm | 7,34 a 10 kg | 10 a 11 cm | 3 a 4 kg | 155g |
| 244Cm | 13,5 a 30 kg | 12,4 a 16 cm | ||
| 245Cm | 9,41 a 12,3 kg | 11 a 12 cm | 3 a 4 kg | 59 g |
| 246Cm | 18 a 21 cm | |||
| 247Cm | 6,94 a 7,06 kg | 9,9 cm | 3 a 4 kg | 1,55 kg |
| 248Cm | 40,4 kg | 19,2 cm | ||
| 250Cm | 16 cm |
Las masas críticas de los isótopos impares rondan los 3 a 4 kg cuando están provistos de reflectores. Estas masas se reducen en solución acuosa con reflector. La precisión de estos valores se acerca al 15%. En efecto, los datos físicos pertinentes son inciertos y según las fuentes, las indicaciones son muy variables. Su rareza, su elevado precio y una ley alemana quitan al curio su uso como combustible nuclear.
Los curio 245 y 247 tienen una utilización en la construcción de reactores y armas nucleares. Debido a su corta vida útil, el 243Cm utilizado en las bombas debe estar en constante mantenimiento. Además, el curio 243 transforma la energía en calor por su desintegración α. Esta capacidad dificulta la construcción de una bomba. Sin embargo, la baja masa crítica de algunas sería apta para la construcción de mini-bombas.
Debido a la escasa disponibilidad del curio, no se ha realizado ningún estudio sobre bombas miniaturizadas.
El curio solo posee radionucleidos. Sin embargo, no tiene isótopos estables. Se han identificado veinte isótopos y siete isómeros: desde 233Cm hasta 252Cm. El curio 247 y el curio 248 tienen las vidas medias más largas, respectivamente de 15,6 × 106 años y 348.000 años. La vida media del 245Cm es de 8.500 años, la del 250Cm de 8.300 años y la del 246Cm de 4.760 años. Aproximadamente el 86% de las desintegraciones del curio 250 son fisiones espontáneas. Este hecho suscita curiosidad.
El curio 242 y el curio 244 son los isótopos más utilizados. Sus vidas medias son respectivamente de 162,8 días y 18,1 años.
Los neutrones térmicos inducen una fisión. Las secciones eficaces son aproximadamente:
| 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | 248Cm |
| 5 barns | 620 barns | 1,1 barn | 2.100 barns | 0,16 barn | 82 barns | 0,36 barn |
Esta propiedad responde a la regla sobre los nucleidos transuránicos. Estipula que casi todos los nucleidos transuránicos con número impar de neutrones son fácilmente fisibles desde el punto de vista térmico.
El elemento 96 es una de las sustancias más radiactivas. El curio 242 tiene una vida media de 162,8 días y el curio 244 de 18,1 años. Tienen energías α de aproximadamente 6 MeV. De vidas medias cortas, son producidos en los reactores. En comparación con el radio 226, tienen una mayor actividad. El 226Ra tiene una vida media de 1.600 años y es producido en la cadena de desintegración natural uranio-radio. La radiactividad de estos isótopos produce un calor intenso. Si el 244Cm emite 3 W/g, el 242Cm puede emitir hasta 120 W/g. Debido a esta gran emisión de calor, estos isótopos tienen su uso en generadores termoeléctricos de radioisótopos. El trióxido de dicurio (Cm2O3) es una fuente de energía eléctrica para las sondas espaciales.
El uso del 244Cm ha sido particularmente estudiado. Su blindaje de emisor α debe ser más delgado que el de un emisor β. Sin embargo, sus tasas de neutrones, de γ y de fisión espontánea son más marcadas que las del 238Pu. Este último tiene una vida media de 87,7 años. La asociación de una alta tasa de irradiación neutrónica, un blindaje más pesado contra los γ y una vida media más corta favorece al 238Pu.
El 238Pu de los generadores termoeléctricos de radioisótopos para marcapasos fue sustituido por 242Cm. La reacción (n,2n) del 237Np produjo 236Pu. Este último contamina el 238Pu producido en los reactores. La reacción contiene en su cadena de desintegraciones un emisor γ (el 208Tl). La irradiación por deuterio del uranio fabrica 238Pu con defecto. La radiación que fabrica los marcapasos contenidos en los otros isótopos del curio es menos importante. Son muy producidos en los reactores y conducen en la cadena de desintegración a isótopos de larga vida.
El instituto de química Otto Hahn de la sociedad Max-Planck ha desarrollado en Maguncia espectrómetros de rayos X de partículas α. Utilizan como fuente de radiación α el curio 244. Gracias a estos espectrómetros, Soujourner, Opportunity y Spirit pudieron realizar análisis químicos de la roca del suelo marciano. El espectrómetro de rayos X de la sonda Philae de la nave espacial Rosetta también pudo realizar análisis de la composición del cometa 67P/Churyumov-Gerasimenko.
Había espectrómetros α a bordo de las sondas espaciales Surveyor 5 a 7. Con la ayuda del 242Cm, medían los protones obtenidos por eyección de partículas α. También evalúan las partículas α devueltas hacia atrás.
La producción de transactínidos y transuránicos más elevados utiliza curio. El seaborgio 265 es el producto de la irradiación del curio 248 por núcleos de oxígeno 18. Los hassios 269 y 270 se obtienen por irradiación del curio 248 por núcleos de magnesio 26.
Un reglamento alemán indica el grado de peligro de una sustancia. El curio y sus compuestos no están contemplados por la lista. Esta última solo se interesa por los riesgos químicos que son despreciables en comparación con la radiactividad. Los peligros de la radiactividad solo son importantes con cierta cantidad de materiales.
Debido a la existencia exclusiva de isótopos radiactivos, la manipulación del curio y sus compuestos debe hacerse en laboratorios especializados y seguros. Debe evitar incorporar los isótopos corrientes emisores α. La mayoría de los isótopos se desintegran en parte por fisión espontánea. Los productos de fisión tienen un amplio espectro y a menudo son radiactivos. Emiten radiaciones γ de alta energía. Esto confiere un riesgo adicional y debe tenerse en cuenta al redactar las consignas de seguridad.
En caso de absorción con alimentos, la mayor parte del curio es excretada. Solo el 0,05% del curio ingerido pasa a la circulación general. Aproximadamente el 45% de esta cantidad se deposita luego en los huesos. El hígado también es sede del 45% del elemento 96 y el 10% restante es eliminado.
La hematopoyesis o producción de glóbulos rojos se detiene por un depósito de curio entre la médula y el cuerpo óseo. Luego viene una difusión lenta hacia la cortical.
La inhalación de curio acumula una mayor cantidad. Esta forma de absorción presenta así un alto riesgo. En forma soluble, el 244Cm tiene una carga total admisible para el cuerpo humano de 0,3 µCi.
El principal riesgo de la ingestión de curio por el hombre es una elevación de la tasa de cánceres de huesos. Esto se observó durante un experimento realizado en ratas. Consistía en inyectar por vía intravenosa curio 242 y 244. El cáncer de hígado y de pulmón son los resultados de la inhalación de los isótopos del curio.
Los isótopos del curio se forman por reacciones (n, γ) seguidas de desintegración β. Esta formación ocurre en los reactores nucleares con una larga duración de uso de combustibles. Aproximadamente 20 g de variedades de isótopos de curio están contenidos en una tonelada de combustibles usados. Los emisores α de número de masa entre 245 y 248 son indeseables en los residuos radiactivos. Esto se debe a su larga vida media. Deben contabilizarse como residuos transuránicos. Para reducir su radiotoxicidad de largo período en los almacenamientos definitivos, se podrían separar los isótopos de larga vida de los combustibles irradiados.
Los procesos de separación y transmutación atómica se estudian con miras a eliminar el elemento 96. Tres etapas constituyen el proceso aplicado:
Este concepto tiene por objetivo transformar los isótopos del curio en nucleidos de corta vida. Consistiría en exponer los isótopos a irradiación por neutrón en reactores especializados. Las investigaciones en este sentido están en curso.
El oxígeno ataca fácilmente al curio. Los óxidos de curio tienen grados de oxidación +3 que es el Cm2O3 y +4 que es el CmO2. También se ha identificado un óxido bivalente, el CmO.
El dióxido de curio negro se obtiene directamente a partir de los elementos. En presencia de oxígeno o aire, el procedimiento consiste en calentar el curio metálico. Sin embargo, esta manipulación es delicada. El calentamiento de sales de curio es entonces preferido para las pequeñas cantidades. Estas sales son el nitrato de curio o Cm(NO3)3 y el oxalato de curio o Cm2(C2O4)3.
Una descomposición térmica en el vacío a 600 °C del dióxido de curio da trióxido de dicurio:
4 CmO2 ΔT → 2 Cm2O3 + O2
Otro método consiste en reducir el dióxido de curio con la ayuda del hidrógeno molecular.
El Cm2O3 y el CmO2 son las formas de curio más encontradas en la naturaleza.
Cuatro halógenos estables son la base de los halogenuros de curio.
Precipitar soluciones que contienen curio con iones fluoruros permite la obtención del fluoruro de curio incoloro o CmF3. La transformación de este fluoruro por flúor molecular permite obtener fluoruro de cerio tetravalente o CmF4:
2 CmF3 + F2 → 2 CmF4
Se conoce una serie de fluoruros complejos con un metal alcalino: M7Cm6F31.
La reacción del cloruro de hidrógeno seco HCl y el hidróxido de curio Cm(OH)3 dan cloruro de curio incoloro CmCl3. La formación de yoduro de curio incoloro y de bromuro de curio verde claro emplea el cloruro de curio. El proceso consiste en desplazar el cloro con la ayuda del halogenuro de amonio:
CmCl3 + 3 NH4I → CmI3 + 3 NH4Cl
Los sulfuros y los seleniuros son sales de calcógenos. La acción del selenio gaseoso o del azufre puro a alta temperatura permite tener estas sales.
Las sales de pnictógenos son del tipo CmX. Sus elementos X son el fósforo, el antimonio, el arsénico y el nitrógeno. La acción a alta temperatura de los elementos X con curio metálico o hidruro de curio permite la producción de estas sales.
El uranoceno es un compuesto organometálico formado por uranio y dos ligandos de ciclooctatetraeno. De manera similar, el americio, el protactinio, el neptunio y el torio presentan complejos correspondientes.
Un curioceno es un compuesto análogo al uranoceno. La teoría de los orbitales moleculares supone la síntesis de este (n8-C8H8)2Cm. Las investigaciones aún no han tenido éxito.
a partir de 49€
![]()
Hecho en España
Disponible, 7 días a la semana
Dentro de 14 días, satisfecho o reembolsado
PayPal, tarjeta de crédito, Visa, Mastercard, transferencia bancaria
4x sin intereses desde 30€ de compra con PayPal