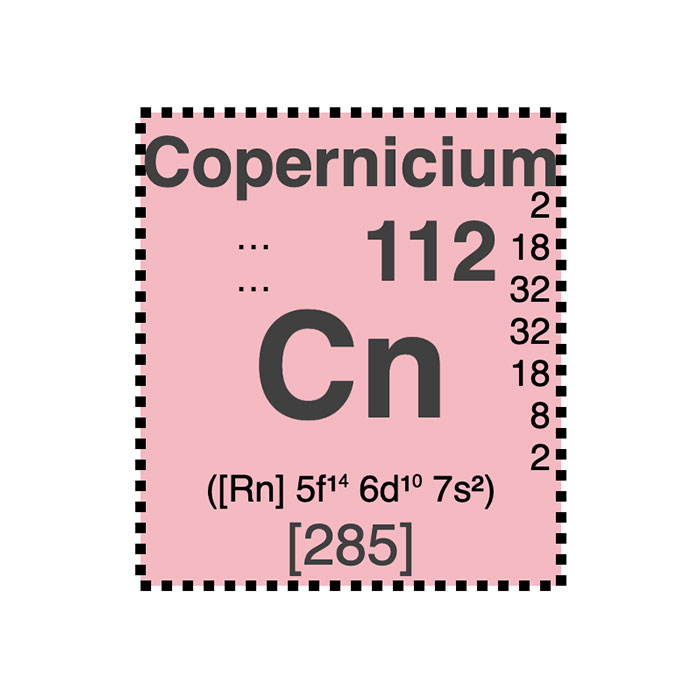
Características del copernicio
- Símbolo: Cn
- Masa atómica: 285 u
- Número CAS: 54084-26-3
- Configuración electrónica: [Rn] 5f14 6d10 7s2
- Número atómico: 112
- Grupo: 12
- Bloque: Bloque d
- Familia de elementos: Metal de transición o metal pobre
- Electronegatividad: –
- Punto de fusión: –

