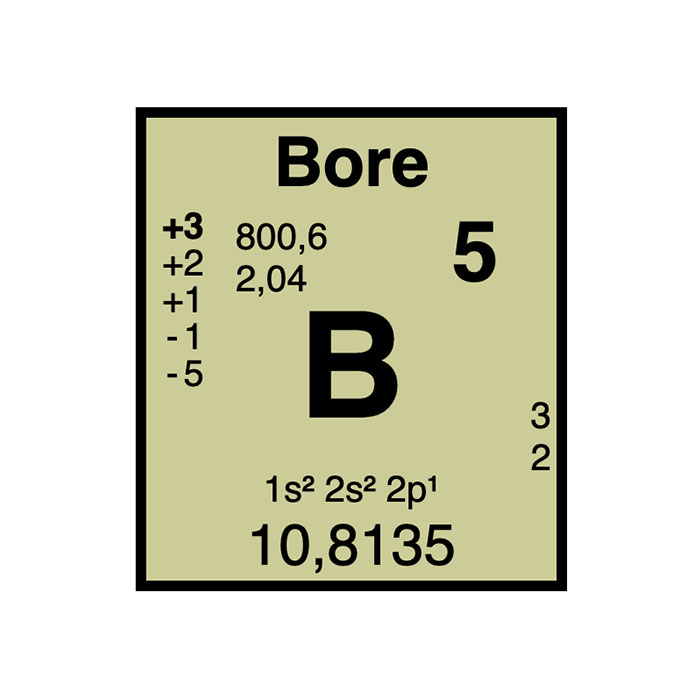
Características del Boro
- Símbolo: B
- Masa atómica: 10,81 u1
- Número CAS: 7440-42-86
- Configuración electrónica: [He]2s2 2p1
- Número atómico: 5
- Grupo: 13
- Bloque: Bloque P
- Familia de elementos: Metaloide
- Electronegatividad: 2,04
- Punto de fusión: 2 075 °C4
NAVIDAD : ¡ Hasta un 50 % de descuento en todo el sitio ! + Regalo sorpresa ! + Sorteo del 01/12 al 25/12: ¡3 Cúmulo de Cuarzo en juego! |

Con el símbolo B, el boro figura en la tabla periódica en el grupo 13. Su número atómico es el 5. Como el berilio y el litio, este componente no está catalogado en el proceso de nucleosíntesis. Su presencia en cantidad ínfima en el espacio es causada por la espalación cósmica (bombardeo interestelar sobre elementos químicos más pesados). El boro es un cuerpo simple categorizado entre los metaloides trivalentes. Esto significa que conduce el calor y la electricidad, pero su poder en este sentido es muy limitado. En principio, está presente en forma de boratos en la superficie terrestre en una proporción de 0,001%, es decir 10 ppm (partes por millón). Este elemento químico también está disponible en muy pequeña cantidad en el sistema solar y en los océanos. En este último caso, se denomina “ácido bórico”.
Conviene precisar que el boro se presenta en dos variedades. El boro amorfo se presenta en forma de polvo marrón. En cuanto al boro cristalino, es de color negro y se caracteriza por su gran dureza (9,3 en la escala de Mohs).
El boro ha captado la atención de científicos e industriales por numerosas razones, especialmente por sus compuestos. Polivalente, este elemento químico puede utilizarse en un gran número de aplicaciones. Tiene la particularidad de ser estable y resistir la corrosión. Su estudio ha permitido una mejor comprensión del proceso de enlace químico. Además, este metaloide es relativamente barato y fácil de tratar. Juega un papel significativo en el sector automotriz, aeronáutico y electrónico. A modo de ilustración, el perborato de sodio Na2B2O4(OH)4 constituye uno de los ingredientes contenidos en detergentes y jabones. En cuanto al bórax Na2B4O7·10H2O, está principalmente presente en materiales de construcción como las fibras de vidrio.

El boro es una palabra derivada del persa “burah” que significa brillante. También puede estar asociado a un término árabe “buraq”. Este elemento químico ha sido utilizado por diferentes civilizaciones durante milenios. Figuraba en el proceso de momificación en el antiguo Egipto. Está notablemente presente en el natrón, un mineral que contiene boratos. Durante la alta Antigüedad, los ceramistas y metalúrgicos ya conocían las propiedades de este metaloide. Según descubrimientos arqueológicos, los chinos utilizaban en el año 300 a.C. arcillas que contenían una gran cantidad de bórax. En cuanto a los romanos, habían integrado el boro en su proceso de fabricación del vidrio.
El elemento simple boro es aislado gracias a las investigaciones realizadas por científicos en 1808 (el barón Louis Jacques Thénard, Gay-Lussac y Humphry Davy). Ellos lograron obtener un compuesto puro al 50%. Sin embargo, todavía no consideraron su descubrimiento como un elemento químico. Esta identificación no se realizó hasta 1824 por Jöns Jacob Berzelius. No obstante, fue el químico estadounidense Ezekiel Weintraub quien obtuvo una muestra pura al 100% en 1909. Realizó experimentos a partir del sesquióxido de boro.
El boro es principalmente conocido por su facilidad de adsorción. Se fija fácilmente a la superficie de cualquier sustancia. También tiene la particularidad de disolverse en un suelo labrado. Por ello, este elemento químico puede ser arrastrado por escorrentía. Está presente en una proporción de 0,001 a 2 mg por litro en las aguas dulces de Europa. Según cifras de la OMS en 2003, los valores del boro son inferiores a 0,6 mg por litro.
Numerosos factores explican la baja cantidad de boro en el suelo. Primero, puede ser causado por un reciente aporte de cal, siendo el pH del suelo superior a 6,6. Las abundantes precipitaciones también pueden ser el origen de las carencias de boro. Estas también se constatan en los suelos arenosos y en aquellos ricos en materia orgánica.
La escorrentía arrastra el boro hacia los océanos. Allí está presente en gran cantidad en forma de ácido bórico. En 1998, el International Programme on Chemical Safety o IPCS registró 4,5 mg de boro por litro. Este elemento químico se encuentra principalmente en los sedimentos marinos. Una ínfima parte se volatiliza en la atmósfera. Este fenómeno se produce debido a la evaporación del ácido bórico marino, pero también a través de incendios forestales, sprays marinos y actividades volcánicas.
Desde hace algunos siglos, la volatilización también se debe a operaciones mineras, a la distribución de productos químicos en zonas agrícolas y a la producción de cerámicas y vidrios. La combustión del carbón en fábricas metalúrgicas y centrales térmicas contribuye, entre otras cosas, a este fenómeno. El boro particulado cae posteriormente sobre tierra o sobre mar en forma de depósitos húmicos o secos.
Sin embargo, el contenido de boro en el aire está comprendido entre 0,5 y 80 ng/m3. Los depósitos en los sedimentos o en el suelo se transforman en boratos gracias a bacterias y hongos. El boro también es adsorbido en el sustrato alcalino con un pH comprendido entre 7,5 y 9. Cuando el medio se acidifica, el boro es desorbido. El ATSDR y el IPCS constataron esta situación en 1992 y 1998.
El boro natural está constituido por sus dos isótopos estables. Las proporciones respectivas de estos últimos varían notablemente entre los boratos de California (bajo contenido en 10B) y los de Turquía (alta concentración en 10B).
Debido a su gran sección eficaz neutrónica (~3838 barns), el boro 10 fue utilizado en los años 1950 como estándar de referencia. Esto llevó a la comercialización de cantidades no despreciables de boro empobrecido en 10B. También fue el caso para el litio empobrecido en 6Li por otras razones. En consecuencia, esta difusión contribuye a la mediocre precisión de la masa atómica del boro.
Se conocen catorce isótopos del boro, cuyo número de masas varía entre 6 y 19. Solo 10B y 11B son estables y presentes en la naturaleza, representando el segundo el 80% del boro natural. Los isótopos radiactivos del boro son muy inestables, con una vida media máxima de 770 milisegundos para el 8B. Estos isótopos se descomponen en isótopos del helio para los más ligeros y en isótopos del carbono para los más pesados. El análisis isotópico del boro puede resultar útil para rastrear los orígenes de ciertos compuestos antropogénicos.
El boro es un elemento semiconductor con una electronegatividad elevada y una baja conductividad térmica. Forma compuestos oxidados que son poco solubles en agua y que se acumulan en la naturaleza. Por ejemplo, el boro se combina con el oxígeno, el azufre y el fósforo para formar sales llamadas boratos. Además, el boro es un ligante muy fuerte, lo que lo convierte en un componente importante en numerosas aleaciones metálicas. También sirve para la fabricación de aceite de motor, productos químicos agrícolas, revestimientos antidesgaste y materiales de construcción.
El boro se utiliza en electrónica como dopante de tipo P (aceptor de electrones / rico en huecos) para el silicio (tetravalente). Este proceso de dopaje consiste en añadir impurezas a un material semiconductor, lo que permite modificar sus propiedades eléctricas. Los compuestos del boro a menudo se comportan como ácidos de Lewis. Se unen fácilmente con especies ricas en electrones para cubrir su déficit electrónico.

El boro es transparente en el espectro infrarrojo. En condiciones normales, su conductividad eléctrica es baja, pero aumenta a alta temperatura. Este elemento químico puede servir en la fabricación de materiales refractarios y aleaciones resistentes a la corrosión. También puede ser utilizado en la fabricación de lubricantes, ácidos bóricos y productos químicos. Es comúnmente empleado en la industria automotriz, en la industria aeronáutica y en la industria de los semiconductores. De igual manera, el uso del boro es frecuente en el tratamiento de aguas residuales y potables. Puede jugar un papel importante en el control del crecimiento de algas y bacterias en los depósitos de agua.
El boro es un elemento particularmente resistente a la tracción. Su nitruro cúbico es tan duro como el diamante y sirve de aislante eléctrico, pero conduce el calor como un metal. Además, el nitruro hexagonal presenta cualidades lubricantes cercanas al grafito. Asimismo, el boro es similar al carbono, ya que es capaz de formar estructuras moleculares estables mediante enlace covalente. Se utiliza como aleación y componente para aceros y metales no ferrosos. También puede emplearse como catalizador en materiales refractarios para la fabricación de fusibles, sondas y bujías. Puede servir en la creación de lubricantes, plásticos, emulsiones y barnices. Del mismo modo, se utiliza en el diseño de productos químicos destinados a productos farmacéuticos, textiles y a la industria alimentaria.
El rojo de rosocianina se forma por un trazador de contaminación urbana presente en los detergentes y detectable en el agua gracias a la curcumina. Se trata del azul de metileno, un colorante que permite detectar las redes de saneamiento contaminadas. El rojo de rosocianina es visible a simple vista y puede medirse con un espectrofotómetro.
El boro está curiosamente presente únicamente en una sola molécula con un papel biológico conocido: AI-2 (autoinducer 2). Esta molécula fue descubierta en 1994 por Bonnie L. Bassler. Permite a las bacterias comunicarse entre ellas para evaluar su número y desencadenar ciertas acciones (como la luminiscencia) solo cuando son numerosas. Como información, el AI-2 es un azúcar que encierra un átomo de boro, lo que le asegura un papel clave en la comunicación interbacteriana.
Bajo alta presión, el boro forma un cristal iónico por sí solo, lo que es inusual en la naturaleza. Esta propiedad se debe a la forma en que sus átomos se ensamblan bajo el efecto de la presión, creando dos tipos de cúmulos con características iónicas diferentes. Estos se comportan respectivamente como cationes y aniones, lo que permite la formación de un cristal iónico. Esta característica reviste una importancia considerable para los investigadores que estudian la estructura y la composición de los materiales a alta presión.
El bórax es uno de los compuestos más importantes del boro debido a su gran variedad de aplicaciones industriales. También se utiliza como aditivo alimentario, como aglutinante para lubricantes y cerámicas, así como para la fabricación de productos químicos. Sirve para crear boratos, fosfatos y ácidos borónicos. De igual manera, también es comúnmente utilizado como agente de soldadura, como desinfectante, como antiséptico y como agente de limpieza.
El boro “amorfo” es un componente esencial en los efectos pirotécnicos, ya que produce un color verde intenso y brillante cuando se calienta a altas temperaturas. Demuestra una gran estabilidad a temperaturas de hasta 2.000 °C, lo que lo hace particularmente adaptado a la formación de ciertas mezclas. En la mayoría de los casos, se combina con combustibles en forma de polvo o granos. La asociación a crear debe decidirse en función del tamaño y del color de la llama deseada.
El ácido bórico es un compuesto químico comúnmente utilizado en la industria textil. Se emplea especialmente en el blanqueado y teñido de tejidos. También es capaz de mejorar la resistencia de estos últimos a los desgarros y al desgaste. Les da también un aspecto más brillante y más cuidado.
El ácido bórico y sus sales han sido utilizados durante mucho tiempo en medicina como medicamentos biocidas. Sin embargo, están siendo progresivamente reemplazados por otros productos más seguros debido a su toxicidad en dosis terapéuticas. En los años 1970-1980, numerosos agentes borados hipolipemiantes, antiinflamatorios o anticancerígenos fueron propuestos y/o desarrollados. Sin embargo, la gran mayoría de ellos no pasaron las pruebas de toxicidad y por lo tanto no fueron aprobados para su uso en medicina humana.
La mezcla de tres partes de ácido bórico y una parte de bórax fue utilizada durante mucho tiempo como conservante alimentario en el siglo XIX. Sin embargo, su uso conoció una viva oposición después de que se descubrieran casos de envenenamientos mortales o graves (por sobredosis o por consumo accidental). Estados Unidos, Francia, Alemania, Países Bajos, Italia, España y, más tardíamente, Gran Bretaña (poco antes de 1928), prohibieron esta práctica. En particular, la leche tratada con boro (Boricized milk) habría sido el origen de trastornos intestinales graves en lactantes.
Los compuestos del boro son comúnmente utilizados en numerosos campos, especialmente en síntesis orgánica y para la fabricación de vidrios borosilicatados como el Pyrex. También se emplean en aleaciones, en la fabricación de aditivos alimentarios, así como de productos fitosanitarios y fertilizantes. Además, el boro es un componente esencial en la formación de numerosos materiales de construcción tales como fibras de vidrio, cerámicas, productos cementosos y aislantes.
Las sales de boro pueden utilizarse como pesticidas, como insecticidas y como fungicidas. Un perfecto ejemplo de su uso es el poliborato (NaB8O13 · 4 H2O). Este juega un papel importante en la lucha contra las termitas y otros insectos xilófagos, así como ciertos tipos de hongos. Presenta la ventaja de penetrar espontáneamente en la madera. Sin embargo, es muy soluble y su vida útil, así como su eficacia, siguen siendo desconocidas hasta hoy. Las sales de boro también se utilizan en antipolillas, en ovicidas y en larvicidas.
Las sales de boro y el ácido bórico fueron antes frecuentemente utilizados como fungicida e ignífugo para la madera y la guata de celulosa. La mayoría de las personas creían que estos productos presentaban una baja toxicidad para el ser humano. Sin embargo, estudios han mostrado que son, en realidad, tóxicos para los mamíferos y, a priori, para el desarrollo fetal humano. En consecuencia, se realizó una reclasificación del elemento químico el 16 de febrero de 2007. Debido a su ecotoxicidad, el ácido bórico y sus sales han sido considerados como “Reprotóxicos de categoría 2” en el anexo de la 30ª A.T.P. de la directiva 67/548.
En el pasado, el ácido bórico, el borato de sodio, el agua bórica y el agua oxigenada bórica fueron todos utilizados como medicamentos. Habrían sido necesarios, en particular, para el tratamiento profundo de las heridas. Un artículo científico de 1990 lo demostró. Sin embargo, más tarde, este estudio fue considerado como con defectos metodológicos. En cualquier caso, es importante notar cierto matiz entre los impactos del elemento químico 5 en el organismo humano. En efecto, los síntomas de la intoxicación por ácido bórico o sus sales son diferentes de los inducidos directamente por el boro. Los más comunes incluyen:
Estos síntomas fueron constatados en 22,3% de 367 personas que participaron en un estudio. Estas fueron expuestas (por vía oral en la mayoría de los casos) a ácido bórico (84,2%). También fueron puestas en contacto con borato de sodio, agua bórica y agua oxigenada. El objetivo era detectar posibles errores terapéuticos.
El boro natural o enriquecido en 10B es comúnmente utilizado en el campo nuclear. En forma de ácido bórico diluido en agua, se emplea como absorbente neutrónico en los reactores nucleares de agua presurizada. De igual manera, el boro puede servir como escudo contra las radiaciones neutrónicas y también se utiliza en los detectores de neutrones.
El neodimio es un elemento químico de la serie de los lantánidos a menudo utilizado para la fabricación de imanes permanentes. Generalmente se mezcla con hierro y boro (Nd2Fe14B) para producir imanes extremadamente potentes y duraderos. Estos pueden integrarse en sistemas de motores eléctricos o de altavoces. También pueden convertirse en un componente de ciertos electrodomésticos, equipos electrónicos, aparatos de elevación y manipulación, etc.
En metalurgia, el boro se utiliza para reforzar la resistencia de las juntas de grano. La combinación de boro y titanio (llamada “pareja titanio-boro”) es muy eficaz para mejorar las propiedades mecánicas de los aceros templados y revenidos, especialmente aumentando su templabilidad. En este aspecto, es particularmente importante velar por que la dosificación sea precisa. Según ciertas normas de elaboración, las concentraciones en boro no deben superar las 5 ppm (en masa).
Numerosos compuestos de boro están actualmente siendo estudiados por su potencial aplicación en:
Estos compuestos son considerados como herramientas poderosas para el desarrollo de tecnologías innovadoras y sostenibles.
El boro es un dopante de tipo P que puede añadirse a un diamante natural para mejorar su conductividad eléctrica. En este caso, éste puede adquirir propiedades metálicas y ser utilizado como un electrodo. Los electrodos a base de diamante dopado con boro demuestran una gran utilidad, ya que permiten reducir los nitratos. También son capaces de oxidar ciertos contaminantes orgánicos en el agua sin dañar el líquido mismo. De igual manera, es posible utilizar el boro dopado para producir compuestos organometálicos complejos. Gracias a sus propiedades de conductividad eléctrica, estabilidad y resistencia a altas temperaturas, el diamante dopado con boro se vuelve particularmente versátil. Puede notablemente encontrar aplicaciones en la industria de semiconductores y en la electroquímica.
El diborano es un ergol de gran interés en la investigación espacial. Produce un impulso específico muy elevado cuando se combina con el difluoruro de oxígeno.
La utilización del boro en combinación con hidrógeno también se contempla como combustible para la fusión neutrónica en el futuro.
El boro no se presenta en estado puro en la naturaleza. Generalmente adopta formas combinadas como el bórax (tincalita), el ácido bórico, la colemanita, la kernita, la ulexita y varios boratos. Además, se puede encontrar ácido bórico en fuentes de agua volcánica. La ulexita, en particular, es un mineral de boro que presenta naturalmente propiedades de fibra óptica.
Estados Unidos y Turquía son los mayores productores mundiales de boro. Mientras que el primero dispone de un importante yacimiento de mineral de rasorita en el desierto de los Mojaves, el segundo posee inmensas reservas de mineral de bórax. Juntos, representan el 86% de las reservas mundiales de boro, con Turquía al 73% y Estados Unidos al 13%.
Para obtener boro puro, hay que implementar técnicas particularmente sofisticadas y complejas. Los primeros métodos que se desarrollaron en la materia consistían en reducir el ácido bórico con metales como el magnesio y el aluminio. Sin embargo, el resultado obtenido era, en la mayoría de los casos, siempre contaminado por boruros metálicos. Una forma más eficaz de obtener el elemento químico 5 es producirlo reduciendo halogenuros de boro volátiles con hidrógeno a altas temperaturas. Esta técnica permite alcanzar una pureza de casi 99,9999%. En cualquier caso, pueden implementarse otros métodos de purificación para obtener un boro aún más puro.
El boro contendría un oligoelemento en baja dosis que tiene un impacto más o menos considerable en los vegetales y en los animales, incluyendo al ser humano.
El boro es un metaloide que se presenta en el medio ambiente en forma iónica o mineral amorfa. Es uno de los siete componentes esenciales de los vegetales. Contribuye a mantener la integridad de las paredes celulares y es indispensable para el crecimiento de los tubos polínicos. Solo los vegetales son susceptibles de bioacumular el boro. Las verduras contienen generalmente entre 0,025 y 0,05 mg/g de peso seco. Las frutas poseen entre 0,005 y 0,0005 mg/g y los cereales, así como sus granos, entre 0,001 y 0,005 mg/g. En la madera del árbol, el boro se estabiliza en el floema. Es poco transferible a otros tejidos, excepto para ciertas especies, principalmente los manzanos. Las raíces contienen menos, al contrario de las hojas.

Un exceso de boro en el suelo puede causar necrosis marginales de las hojas y afectar el crecimiento de plantas silvestres o cultivadas. Algunos derivados del boro han sido empleados como pesticidas herbicidas que, en gran cantidad, pueden matar a los vegetales. Sin embargo, un nivel demasiado bajo (inferior a 0,8 ppm) también puede producir los mismos síntomas en plantas particularmente sensibles al boro del suelo (árboles frutales).
Un estudio realizado en 2010 en California puso en evidencia el papel agravante de la acidez del suelo (pH bajo) en la fitotoxicidad del boro. Un aumento del nivel de boro en un suelo ligeramente ácido se acompaña de una disminución de la diversidad bacteriana asociada a las raíces de los pepinos. Estos últimos fueron cultivados en un suelo salinizado por el riego con agua dura.
Las plantas absorben el boro de su entorno, principalmente del agua y del suelo. Cuando crecen, lo almacenan en sus tejidos, concentrándolo a veces a niveles más altos que los presentes en el suelo. Una vez absorbido, el boro es transportado a los diferentes órganos de las plantas, lo que puede conllevar efectos negativos. Es susceptible de provocar la disminución del crecimiento, la productividad y la calidad de los productos agrícolas. En pocas palabras, la toxicidad del boro para las plantas depende de diversos factores. Varía en función del contenido de boro del suelo, del pH del suelo y del tipo de planta.
El boro es un nutriente esencial que juega un papel importante en el metabolismo óseo, la salud dental y el sistema inmunológico. Es necesario para el crecimiento y desarrollo de los huesos. También es esencial para la síntesis de proteínas, la producción de hormonas y la utilización óptima de vitaminas y minerales. De igual manera, puede ayudar a la asimilación de ácidos grasos. El boro interviene también en la regulación de enzimas y hormonas, así como en el metabolismo de carbohidratos y lípidos. Una carencia puede por tanto conllevar efectos nefastos para la salud.
El ácido maleico es considerado tóxico para los invertebrados acuáticos en dosis relativamente bajas. Tal fue especialmente el resultado de un estudio realizado sobre el camarón Litopenaeus vannamei. Este mostró que concentraciones de algunas decenas de miligramos de ácido maleico por litro de agua son tóxicas para este organismo. En cualquier caso, conviene precisar que esta toxicidad depende mayoritariamente de la salinidad del líquido. Investigaciones sobre el lenguado y el mújol labeo también probaron que los peces marinos son menos sensibles al ácido maleico.
Sin embargo, en altas dosis, el compuesto es tóxico para los animales. Estudios recientes han mostrado que puede tener un efecto negativo sobre el sistema inmunológico y cardiovascular. En efecto, inhibe la función y la respuesta de las células inmunitarias. También ha sido asociado a consecuencias nefastas sobre el desarrollo y el comportamiento de los animales. El ácido maleico daña la salud cardíaca y mental. Puede causar lesiones musculares y nerviosas.
No es seguro que el boro sea un elemento absolutamente indispensable para el metabolismo del calcio óseo. Sin embargo, estudios han demostrado que la suplementación con boro puede tener un efecto sobre el metabolismo del calcio óseo. Los resultados son mucho más marcados cuando otros nutrientes y micronutrientes como el colecalciferol y el magnesio están presentes.
Por otra parte, existen indicaciones según las cuales el boro podría tener un efecto beneficioso para la salud, siempre que se consuma en pequeñas dosis. Según la OMS, hay que respetar una cantidad de 1 a 13 mg/día. Estudios epidemiológicos también han proporcionado algunas informaciones sorprendentes. Los habitantes de zonas mineras donde se explota el boro presentan una tasa particularmente baja de cánceres y enfermedades músculo-esqueléticas. Sin embargo, todavía es difícil determinar si esta relación es realmente causal.
En ciertas regiones, el agua de pozo puede contener naturalmente concentraciones elevadas de boro y flúor. Estos contenidos demasiado elevados son susceptibles de provocar fluorosis dental. Sin embargo, un estudio inglés realizado en 2010 mostró que la contaminación por boro como aditivo de productos de limpieza está en descenso. En efecto, el boro ha sido masivamente utilizado como ignífugo y ha contaminado las aguas superficiales. No obstante, actualmente se están implementando medidas de prevención y control de la contaminación para reducir esta fuente de polución.
Los resultados de este estudio inglés sugieren que la inhalación de trifluoruro de boro (BF3) asociado al flúor es extremadamente tóxica para las ratas. Una exposición a 180 mg/m3 de aire durante dos semanas provocó la muerte de la totalidad de estas. Los siguientes síntomas fueron observados en aquellas que fueron puestas en contacto con 66 y 24 mg/m3:
Estos efectos eran de tipo “dosis-dependiente” y se constató una toxicidad renal significativa a 17 mg/m3 de aire. Los resultados de este estudio indican que la inhalación de trifluoruro de boro asociado al flúor puede ser extremadamente tóxica, incluso a niveles de exposición bajos.
Los datos epidemiológicos disponibles no permiten evaluar la exposición a niveles elevados de boro, ya que este tipo de situación es rara en el ser humano. Sin embargo, los datos toxicológicos procedentes de experimentos animales muestran que esto puede conllevar consecuencias negativas sobre la reproducción y el desarrollo. La exposición a niveles elevados de boro es susceptible de provocar anomalías de la espermatogénesis y una disminución de la fertilidad.
El boro tiene un papel importante en el metabolismo y el desarrollo celular. Está implicado en la regulación de ciertos procesos fisiológicos, especialmente el transporte transmembrana, la síntesis de la matriz extracelular y la cicatrización de heridas. Una suplementación con boro puede aumentar los niveles séricos de β-estradiol y testosterona. Sin embargo, es susceptible de tener efectos reprotóxicos e inhibir la función reproductiva. En humanos y animales, el boro es menos comprendido que en los vegetales, pero su importancia para la salud es evidente.
No obstante, un exceso de boro puede provocar toxicidad hepática, hipertiroidismo e hipercalcemia. Estudios de cohorte también han mostrado que el boro puede estar asociado a un riesgo aumentado de cáncer de pulmón, próstata y vías biliares. Además, investigaciones de laboratorio y epidemiológicas sugieren que el boro puede provocar impactos negativos sobre el desarrollo del cerebro y del sistema nervioso.
El boro es un oligoelemento importante que puede encontrarse en numerosos alimentos. Las verduras de hoja, los frutos secos, los granos enteros y las frutas secas son especialmente ricos en boro. Los alimentos de origen animal como el pescado, la carne y los productos lácteos también son fuentes importantes. La cantidad de boro en los alimentos varía según el tipo de suelo en el que fueron cultivados. También depende de los métodos de tratamiento y preparación de estos.
Estudios recientes han mostrado que el boro puede ayudar a regular los niveles de hormonas y ácidos grasos y a mejorar el metabolismo de los carbohidratos. También se ha sugerido que el boro ayuda a prevenir la osteoporosis favoreciendo la renovación de los huesos y reduciendo la excreción de calcio. Finalmente, puede ayudar a reducir la inflamación y a proteger contra enfermedades crónicas como la diabetes y las enfermedades cardíacas.
Según los últimos datos (estudios in vivo e in vitro) disponibles, la piel humana es considerada como una barrera muy eficaz contra el paso percutáneo. Sin embargo, cuando está dañada, abrasada o herida, esta protección se vuelve inútil. Los estudios que permitieron recoger estos datos son más recientes y se benefician de métodos de análisis del boro en una matriz biológica más sensible.
El uso del modelo in vitro ha sido propuesto para comprender mejor la permeabilidad cutánea. Sugiere por tanto que el boro puede penetrar más profundamente en la piel de lo que se había estimado previamente. Plantea cuestiones sobre el riesgo de este elemento químico para la salud. También ha puesto en evidencia que los efectos tóxicos del boro podrían estar subestimados en estudios anteriores. Los investigadores están llamados a realizar nuevos estudios para evaluar de manera más precisa el paso percutáneo del boro. La toxicidad de este último a niveles de concentración más elevados también debería analizarse una vez más.
Los efectos tóxicos del boro en los mamíferos se traducen principalmente en un fallo testicular y una inhibición del desarrollo fetal. Deben respetarse umbrales específicos para evitar estos efectos nefastos. Una reevaluación toxicológica realizada en 2013 puso en evidencia estos límites e insiste en la necesidad de no superarlos.
Una exposición excesiva al boro es susceptible de provocar infertilidad masculina, que es más o menos reversible según la dosis absorbida. Según diferentes estudios, los efectos negativos son tanto más pronunciados cuanto mayor es la exposición a la sustancia. Esta puede provocar atrofia testicular y deleción de la espermatogénesis. También se sospechan signos de perturbación hormonal. Se propone un umbral de exposición sin efecto nefasto estimado en 17,5 mg de boro por kilo de peso corporal y por día en la rata. Cabe señalar que el boro no se acumula específicamente en los testículos.
Se han observado pérdidas de fertilidad en hembras de ratas y ratones expuestas a 58,8 mg de boro/kg de peso corporal y por día. Un estudio en ratones hembra mostró que dosis superiores a 111,3 mg/kg están asociadas a una disminución de la fertilidad. En ratas de la cepa Sprague-Dawley, la dosis sin efecto nocivo observada es de 10 mg de boro/kg. Se han observado efectos nefastos para el feto a 13 mg/kg de peso corporal y por día.
Un estudio sobre cientos de obreros chinos expuestos al boro puso en evidencia una diferencia de ratio Y/X. Sin embargo, no se observó ningún efecto directo y estadísticamente significativo sobre otras características del esperma. Ningún dato permitió tampoco evaluar el número de hijos engendrados por los trabajadores de la industria del boro en una provincia del norte de China. Estos resultados pueden estar relacionados con la política del hijo único implementada en China que podría ocultar una disminución de fertilidad debida al boro. Sin embargo, también es posible que los seres humanos sean menos sensibles al boro que los ratones, ratas y perros utilizados en laboratorio.
Se ha puesto en evidencia una toxicidad renal acompañada de modificaciones degenerativas visibles a nivel de las células de los túbulos proximales. Su intensidad depende de la dosis y la duración de la exposición.
Durante los años 1980, el envenenamiento accidental por antisépticos que contenían ácido bórico era frecuente. A veces podía ser fatal en lactantes y recién nacidos. Asimismo, también se han provocado envenenamientos por la absorción accidental de pesticidas domésticos, incluyendo los insecticidas, por los animales expuestos a ellos. En otros casos, han sido productos domésticos que contenían boratos los causantes de las intoxicaciones. Los accidentes laborales que implican boranos también han sido responsables de intoxicaciones. En los niños, los casos de intoxicación aguda son más fácilmente detectables, pero también pueden ocurrir intoxicaciones crónicas.
Todas las cantidades de boro ingeridas por el hombre y el animal de laboratorio son absorbidas por la sangre en pocas horas. Sin embargo, la distribución del boro es desigual a través del cuerpo. Está menos concentrado en los tejidos adiposos y más en el hueso, el cerebro y la médula ósea. Esta última contiene cuatro veces más que la sangre.
El ácido bórico no parece ser metabolizado por el animal o el humano, probablemente debido a la energía importante necesaria para romper el enlace BO. Sin embargo, su fuerte afinidad por los grupos químicos cis-Hidroxi podría explicar algunos de los efectos biológicos.
En promedio, el boro tomado por voluntarios humanos tiene una vida media de 21 horas. Durante un estudio de farmacocinética, estos recibieron una dosis única de 562 a 611 mg de ácido bórico por perfusión en 20 minutos. Este reveló que después de 120 horas, el 98,7 (± 9%) de la dosis fue eliminada por la orina. Estudios en ratas han mostrado que la vida media del boro era de aproximadamente 14 a 19 horas. Es significativamente más corta que en el humano.
El boro que no se elimina rápidamente puede ser absorbido de manera duradera por el cerebro y los huesos. En las mujeres embarazadas, la placenta no es un obstáculo para el boro, lo que fue demostrado por un estudio de 2012. Este encontró más de 1.700 mg de litio/L y 14.000 mg de boro/L en la primera orina del recién nacido. Sin embargo, los resultados no fueron analizados más en detalle. Los lactantes están menos expuestos al boro por la leche materna, que contiene menos que la sangre de la madre.
Las nanotecnologías que explotan el boro plantean interrogantes entre toxicólogos, ecotoxicólogos y biólogos celulares. Los cuestionamientos comenzaron desde el advenimiento, en los años 2000, de los nanotubos a base de nitruro de boro.
Los vegetales absorben el boro, un oligoelemento. Como el carbón está principalmente compuesto de restos vegetales, contiene una cantidad no despreciable de boro. El petróleo y el gas natural que derivan de materia orgánica animal contienen menos. Si la combustión del carbón es origen de contaminación ambiental, las cenizas volantes procedentes de centrales térmicas también pueden ser una fuente de boro. En efecto, cuando se observan al microscopio electrónico, estas finas cenizas resultan ser ricas en boro.
Las lentejas de agua han mostrado una buena capacidad para absorber el boro, lo que las convierte en una solución pertinente para la fitorremediación de aguas contaminadas. Sin embargo, el exceso o la carencia de boro puede ser tóxico para esta especie. Es susceptible de obstaculizar el crecimiento, la morfología, la fisiología y la estructura celular de las plantas. Así, afecta su rendimiento en cultivo. Por otro lado, un aporte bien dosificado de boro en un suelo carente puede aumentar los rendimientos de cultivos de vegetales y árboles. Tal es, por ejemplo, el caso de los girasoles y los manzanos.
En 2017, estudios sobre el cultivo hidropónico controlado revelaron que las carencias de boro afectan principalmente a las raíces. Su exceso quema los bordes de las hojas más antiguas. Las concentraciones de enzimas antioxidantes se reducen en caso de déficit de boro. Tales fenómenos también pueden producirse en caso de exceso. La concentración de MDA baja en caso de carencia y aumenta con la concentración de boro. Funciones vitales como la fotosíntesis, la evapotranspiración y la conductancia estomática se reducen tanto en caso de carencia como de exceso.
El contenido de clorofila y carotenoides también disminuye cuando hay carencia o exceso de boro. Se trata de uno de los elementos químicos cuya ecotoxicidad en el suelo ha sido más estudiada. En 2017, especialmente, se publicaron investigaciones y datos científicos sobre sus dosis letales y subletales en el suelo para al menos 38 taxones vegetales.
El boro es tóxico para un gran número de especies del suelo, en particular los suelos ácidos. Las especies más sensibles son Folsomia candida, los enquitreidos y las dicotiledóneas. Las dosis y la duración de exposición aumentan la sensibilidad. Las pruebas de letalidad y evitación son menos significativas que los efectos sobre la reproducción. En el Reino Unido, a finales de los años 1960, vertidos líquidos y gaseosos provocaron un aumento del nivel de boro de las aguas. Este se atenuó posteriormente con el desarrollo de estaciones depuradoras y detergentes sin perborato a partir de los años 1990.
El boro no es reconocido como mutagénico ni cancerígeno. Sin embargo, se sospecha que es reprotóxico. Ha sido empleado durante mucho tiempo como “tóxico de referencia” para calibrar o medir la sensibilidad de pruebas ecotoxicológicas estandarizadas. No obstante, actualmente se buscan opciones menos preocupantes para la salud ambiental.
En ciertas regiones, la contaminación humana ha conducido a suelos y medios salinizados. Además, algunos acuíferos o suelos de varias regiones mineras son naturalmente ricos en boro. Tal es, por ejemplo, el caso del sur de Estados Unidos donde la roca madre aflorante es rica en boro y de regiones. De igual manera, el agua de las regiones turcas de Kirka y Hissarlik contiene entre 2,05 y 29,00 mg de boro por litro (4,08 mg/l en promedio). En estas mismas regiones, la excreción urinaria humana varía de 0,04 a 50,70 mg/l de boro (8,30 ± 10,91 mg boro/l en promedio) en adultos.
Se han realizado estudios sobre la toxicidad ambiental de los boros en cursos de agua. Han mostrado que en ciertos lugares de Europa, los niveles están cerca de los niveles de toxicidad para los insectos acuáticos y otras especies. Prueban que los vertidos antropogénicos de boro ya pueden ser perjudiciales para las regiones donde la concentración natural es más elevada. También pueden ser nefastos para las especies más sensibles a ellos.
Las aguas de riego y las cenizas procedentes de la combustión del carbón o de la madera tratada con boro también pueden causar problemas ambientales. Sus impactos son tanto más importantes cuando se utilizan como enmiendas para el suelo. Los detergentes, biocidas e ignífugos de la madera, de tejidos o de aislantes térmicos también son una fuente potencial de toxicidad ambiental. Cuando estos materiales están al final de su vida útil, los efectos negativos se ven multiplicados.
El boro es un contaminante indeseable de las aguas potables y de riego en altas dosis, ya que es fitotóxico más allá de cierto umbral. Pueden encontrarse niveles elevados de boro en ciertos lugares, como en Turquía y en el sur de Estados Unidos. Son susceptibles de causar problemas de toxicidad. La depuración del boro del agua puede ser costosa, pero es técnicamente factible. Basta, por ejemplo, con utilizar la electrocoagulación, la ósmosis inversa u otros procesos híbridos para la desalinización, como una resina u otros materiales que absorben selectivamente ciertas sales. Una alternativa más reciente es la biorremediación por una microalga (Chlorella), probada y propuesta en 2012. Un método menos costoso podría ser la utilización de las propiedades adsorbentes de ciertas arcillas (naturales o modificadas) para adsorber el boro.
El boro está presente en numerosos alimentos, tales como el aguacate, el cacahuete, la ciruela, la uva, el vino y la nuez pecana. Se encuentra en cantidades importantes en las verduras de hoja (col, lechuga, puerro, apio, etc.), las frutas (excepto los cítricos) así como en los frutos secos.
Desde 2000, la ECHA y el reglamento REACH consideran el ácido bórico como una sustancia muy preocupante debido a sus propiedades reprotóxicas. En Europa, los derivados del boro y del ácido bórico están calificados por las siguientes frases de riesgo desde 2010:
Según las estadísticas de aduanas francesas, Francia es un importador neto de boro en 2014. El precio medio de importación por tonelada era de 570 €.
a partir de 49€
![]()
Hecho en España
Disponible, 7 días a la semana
Dentro de 14 días, satisfecho o reembolsado
PayPal, tarjeta de crédito, Visa, Mastercard, transferencia bancaria
4x sin intereses desde 30€ de compra con PayPal