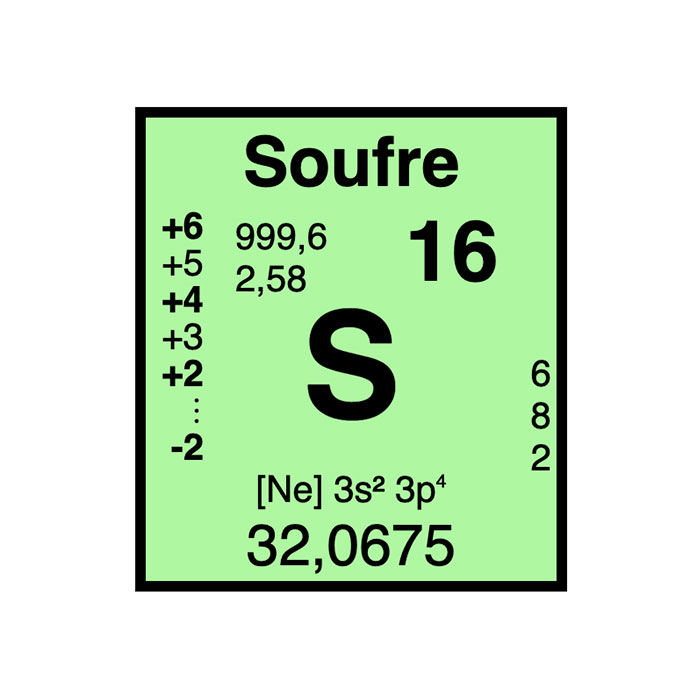
Características del azufre
- Símbolo: S
- Masa atómica: 32,065 ± 0,005 u
- Número CAS: 7704-34-9
- Configuración electrónica: [Ne]3s23p4
- Número atómico: 16
- Grupo: 16
- Bloque: Bloque P
- Familia de elementos: No metal
- Electronegatividad: 2,58
- Punto de fusión: 115,21 °C


