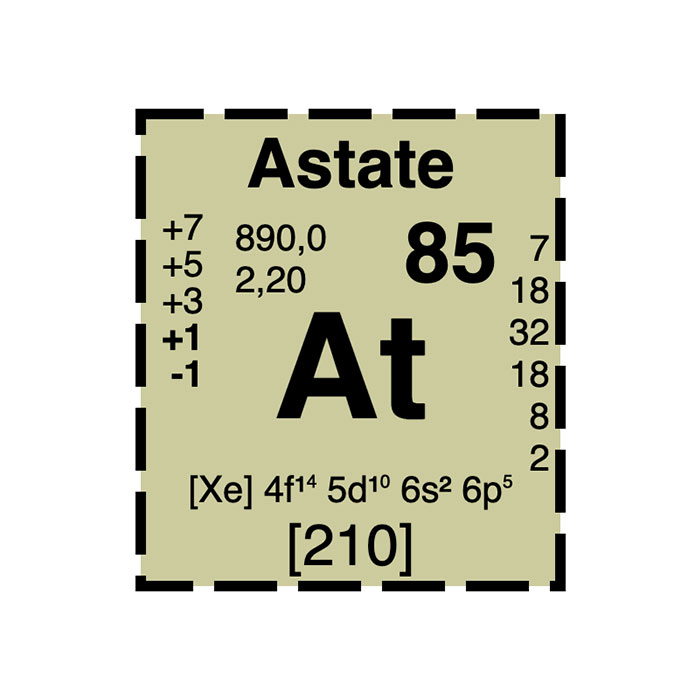
Características del astato
- Símbolo: At
- Masa atómica: 210 u
- Número CAS: 142364-73-6
- Configuración electrónica: [Xe] 4f14 5d10 6s2 6p5
- Número atómico: 85
- Grupo: 17
- Bloque: Bloque p
- Familia de elementos: Halógeno/metaloide
- Electronegatividad: 2,2
- Punto de fusión: 302 °C