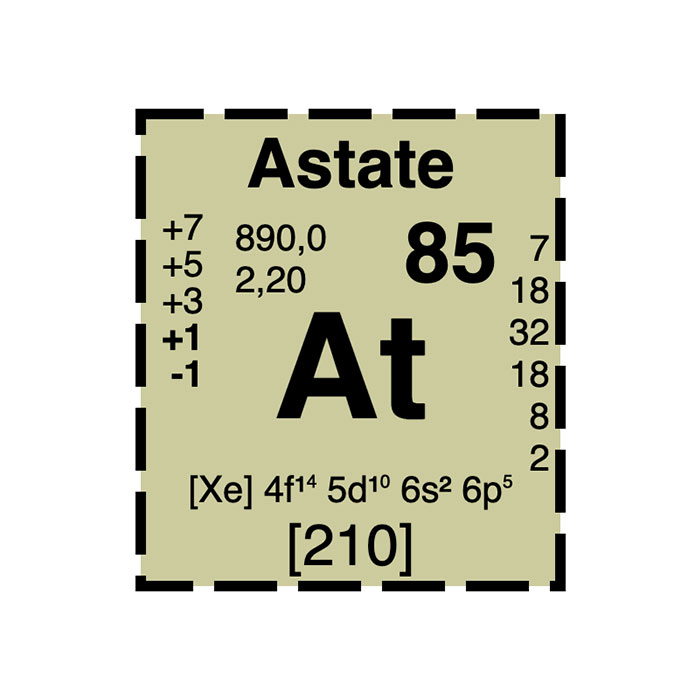
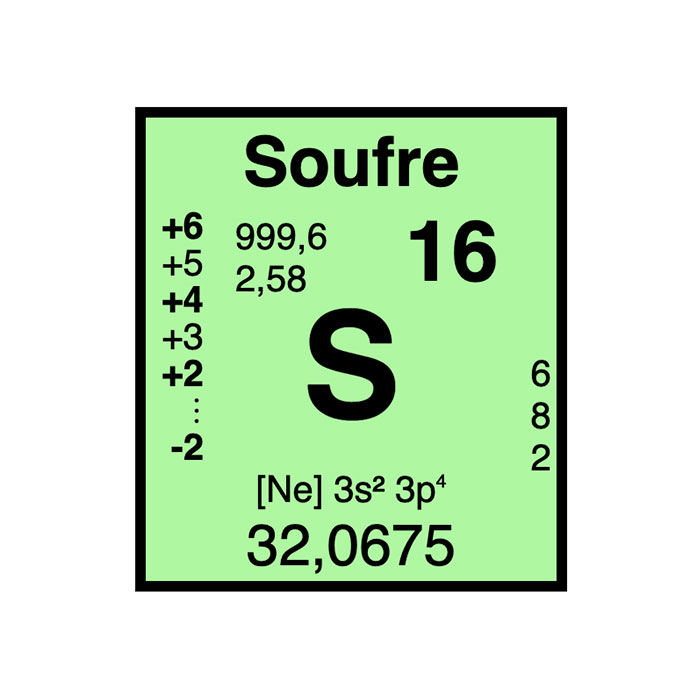
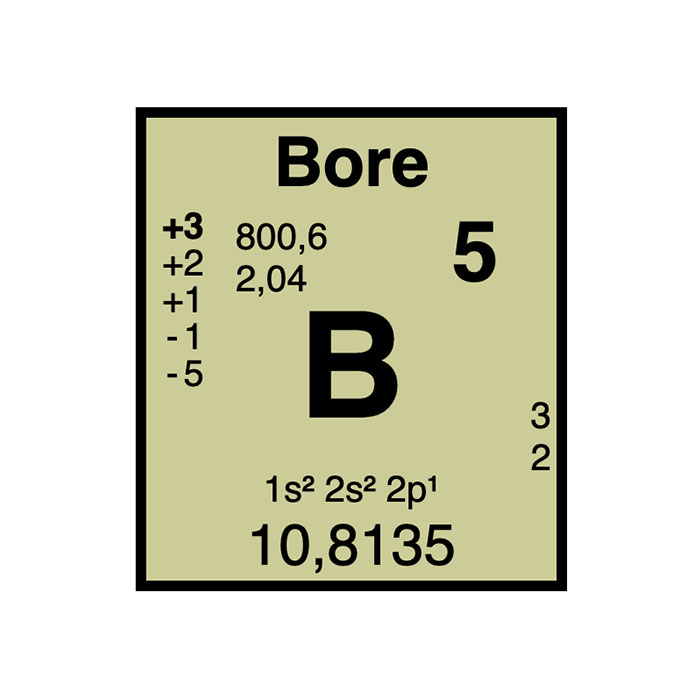
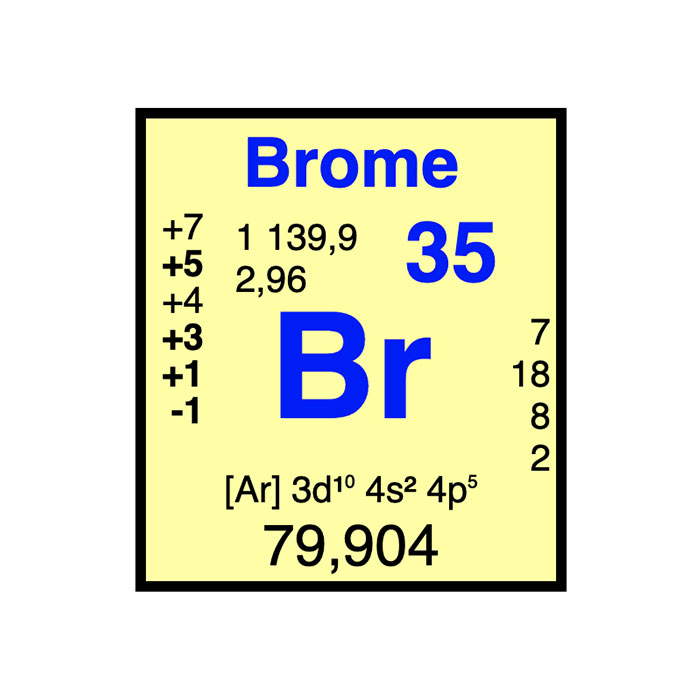
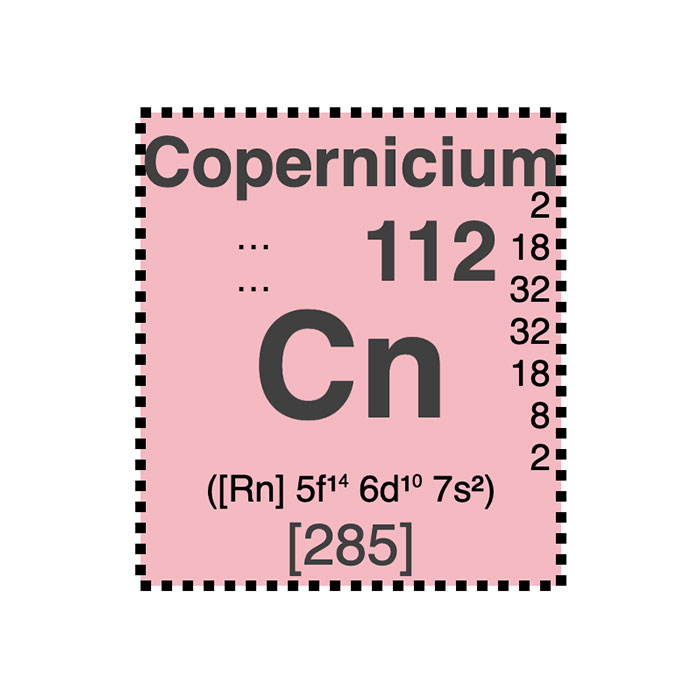
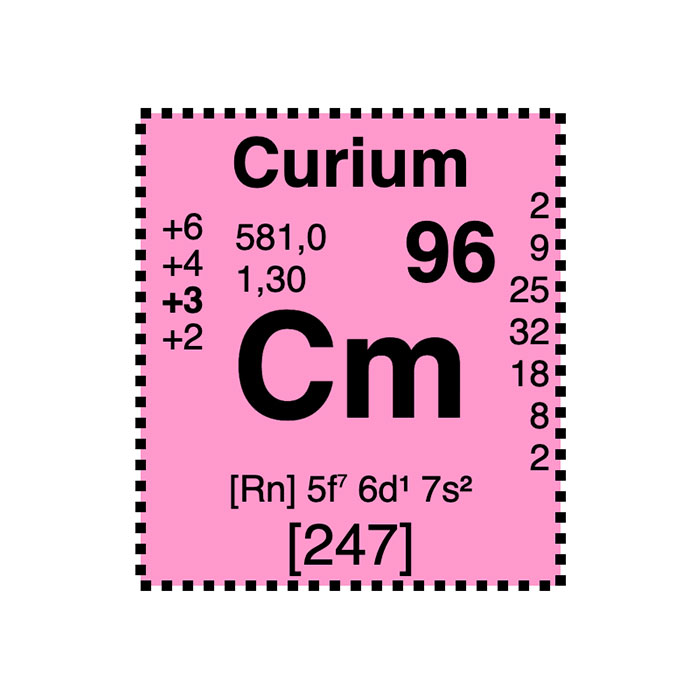
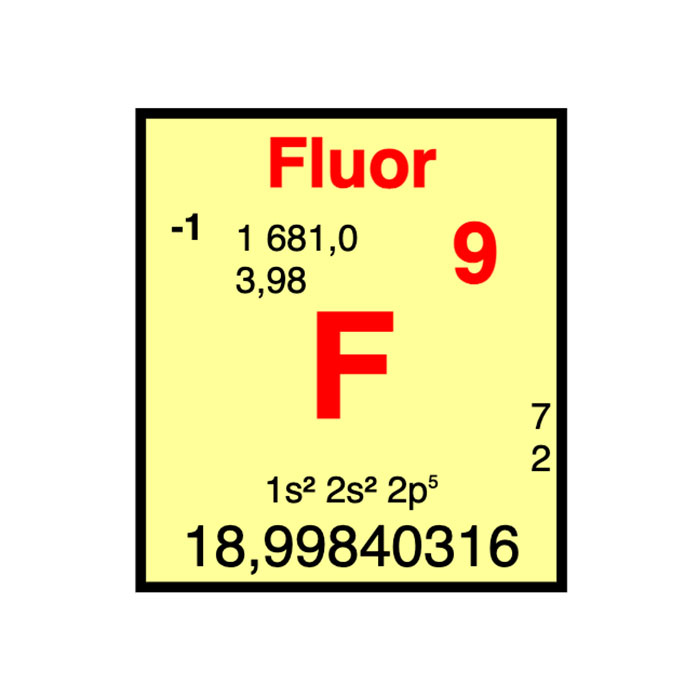
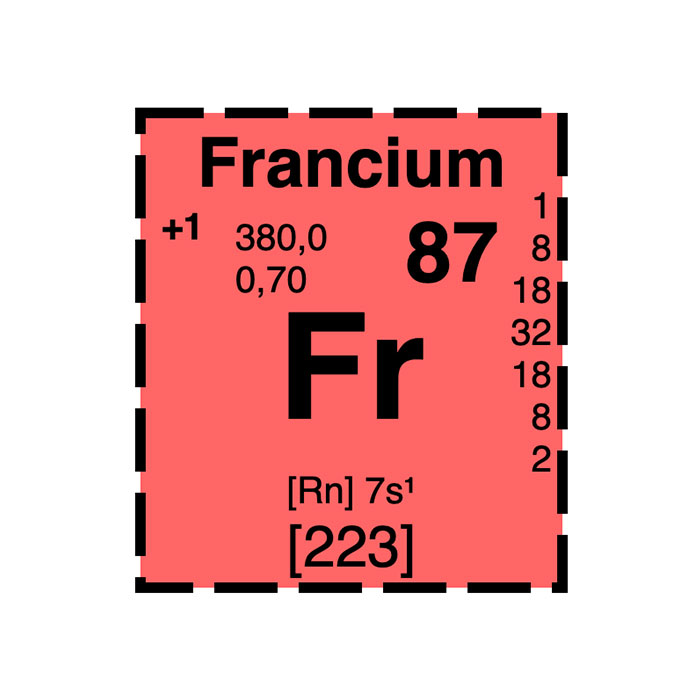
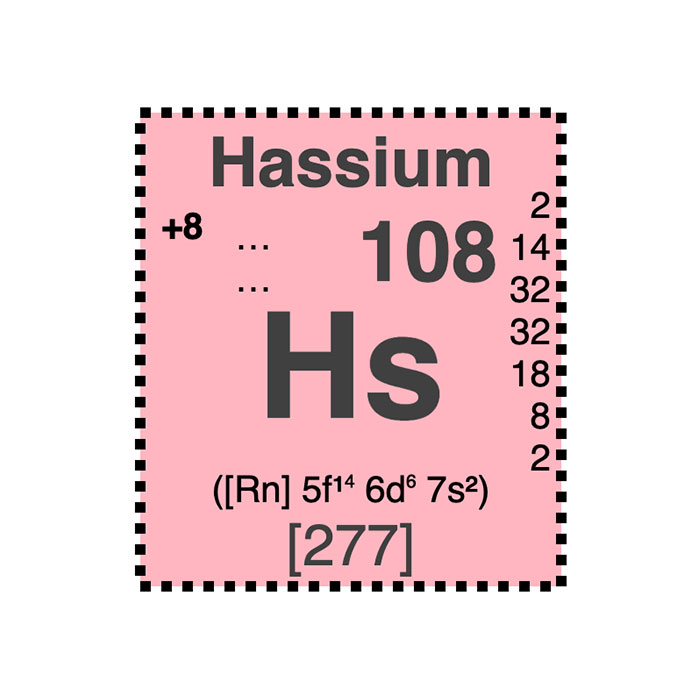
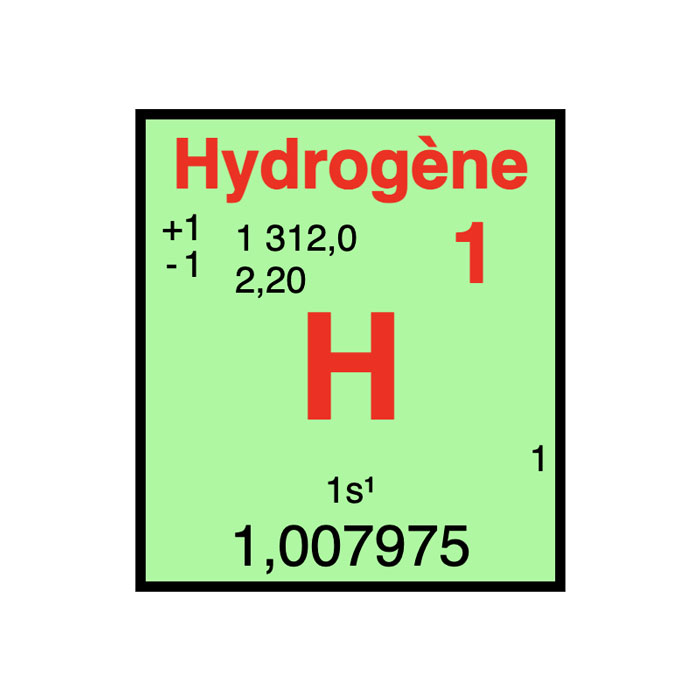
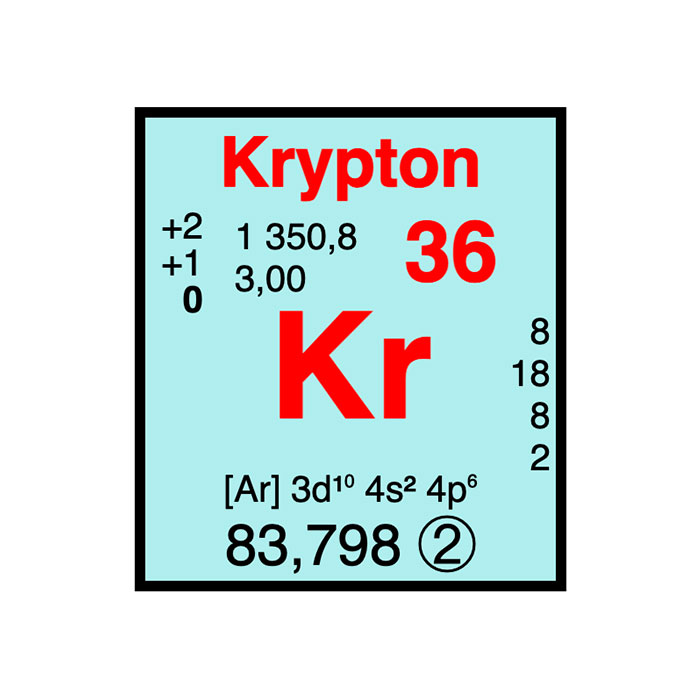
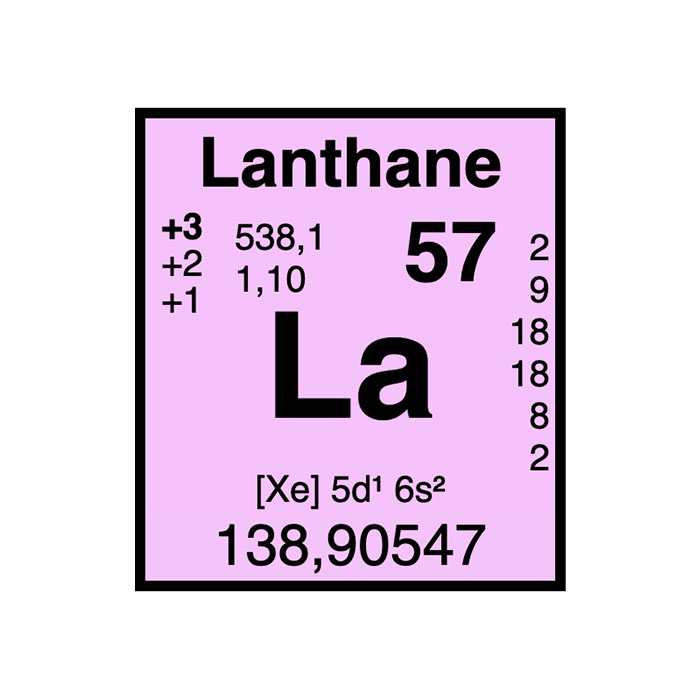
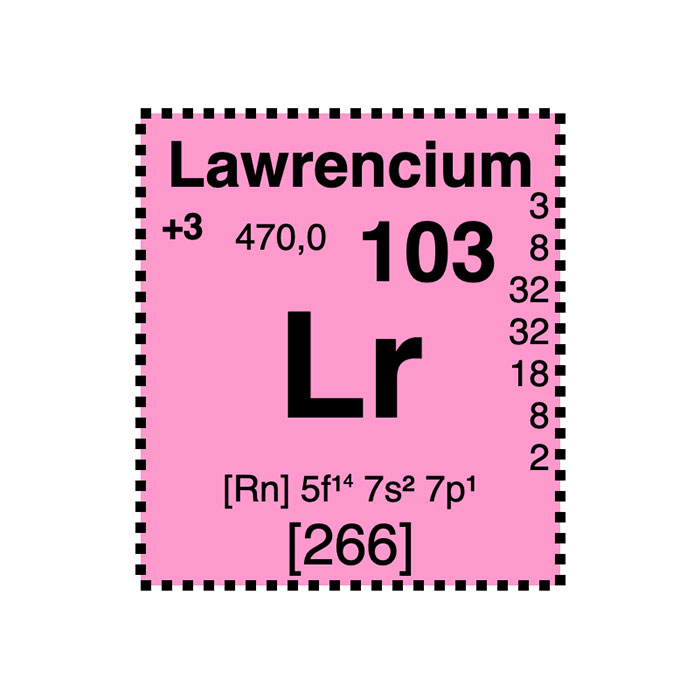
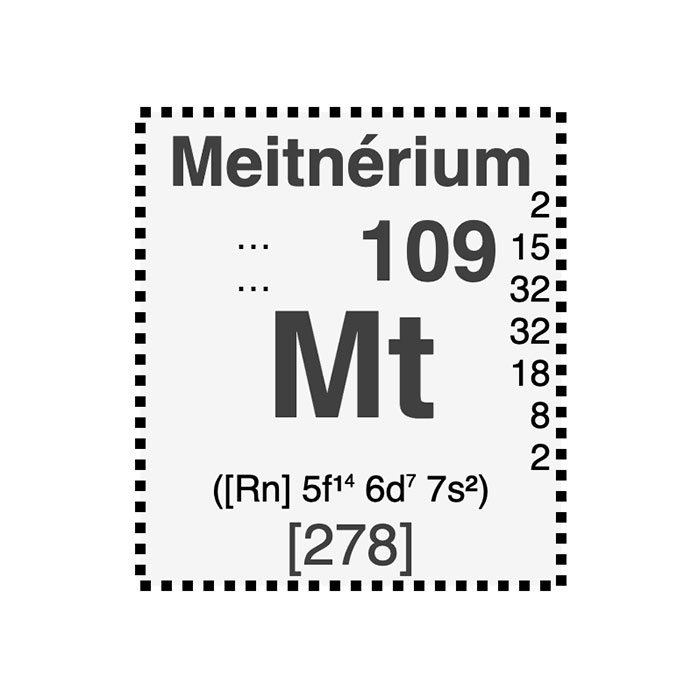
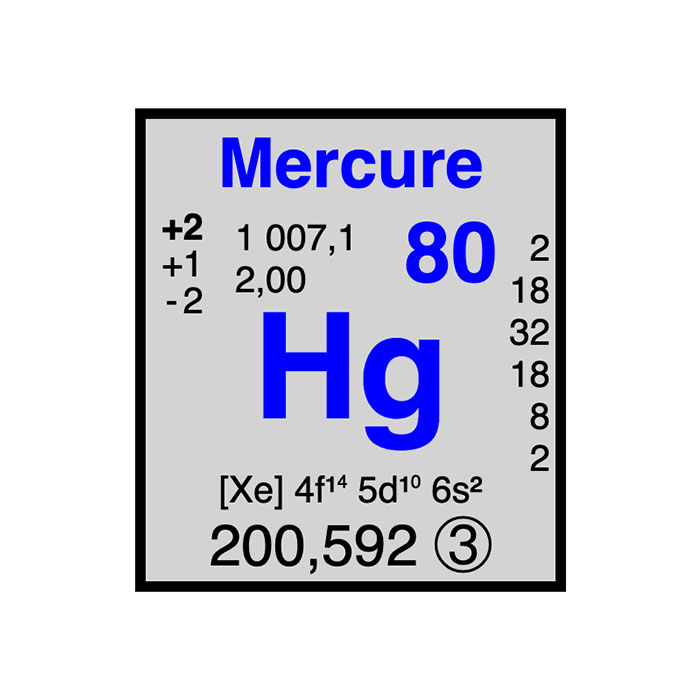
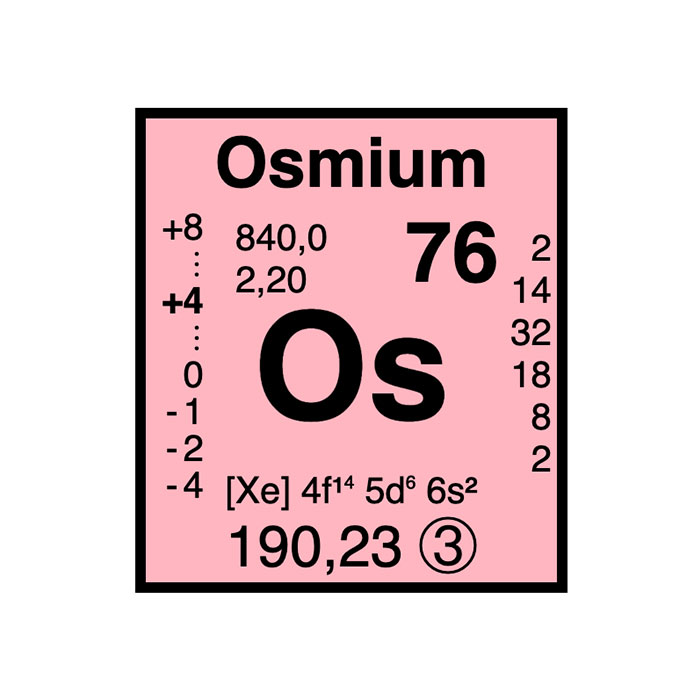
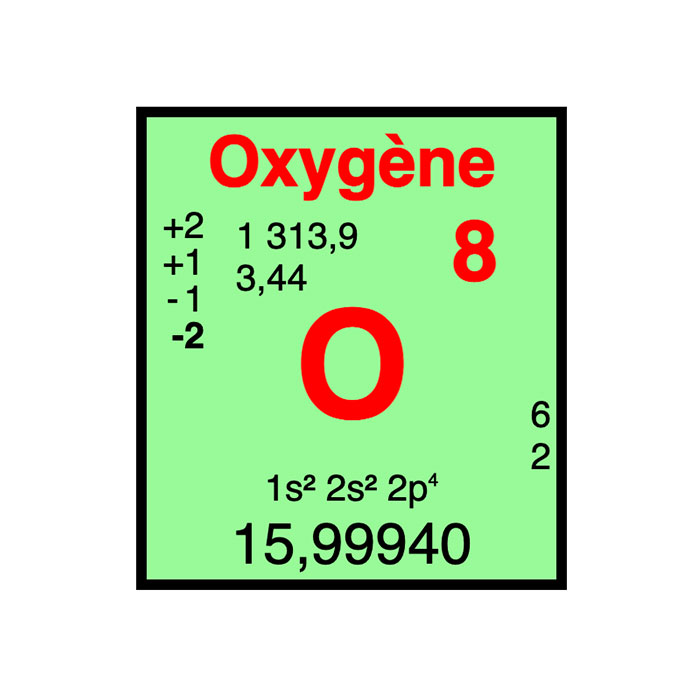
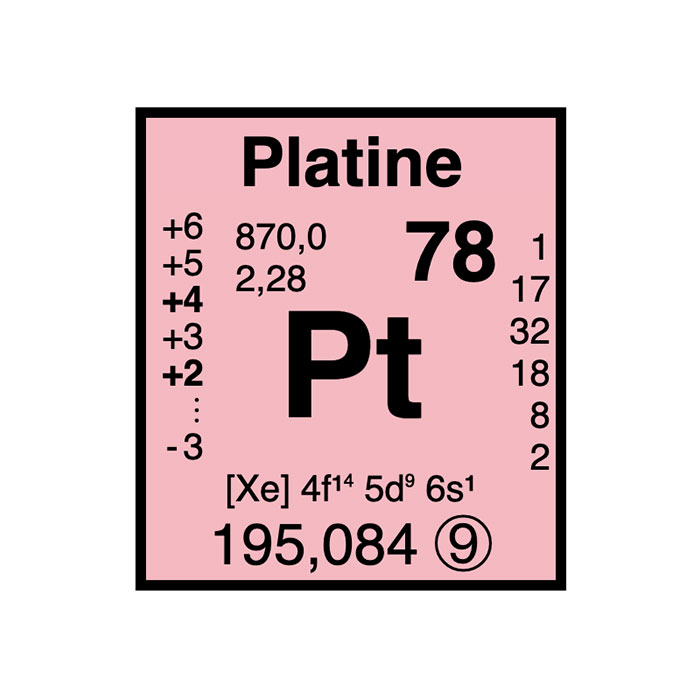
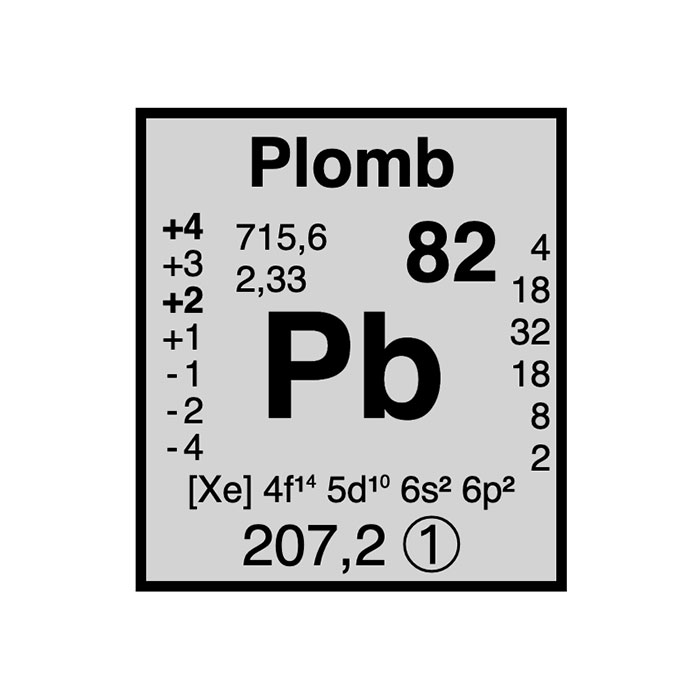
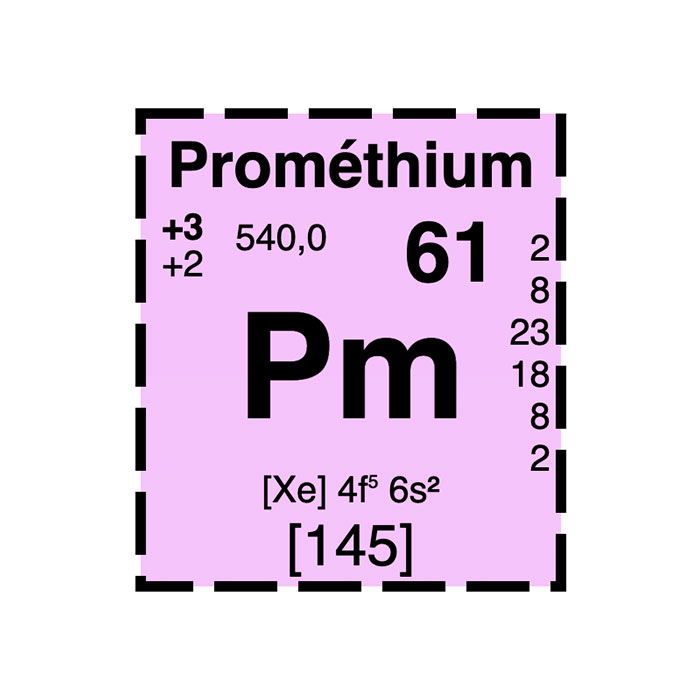
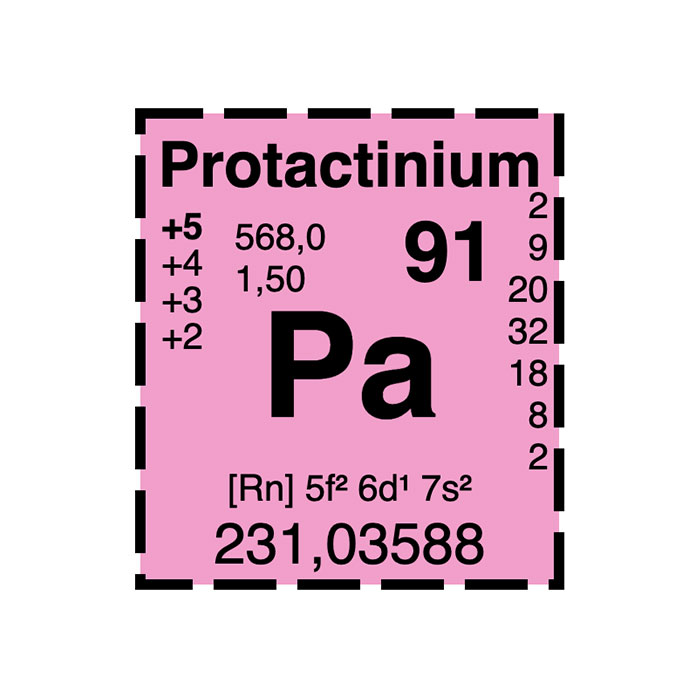
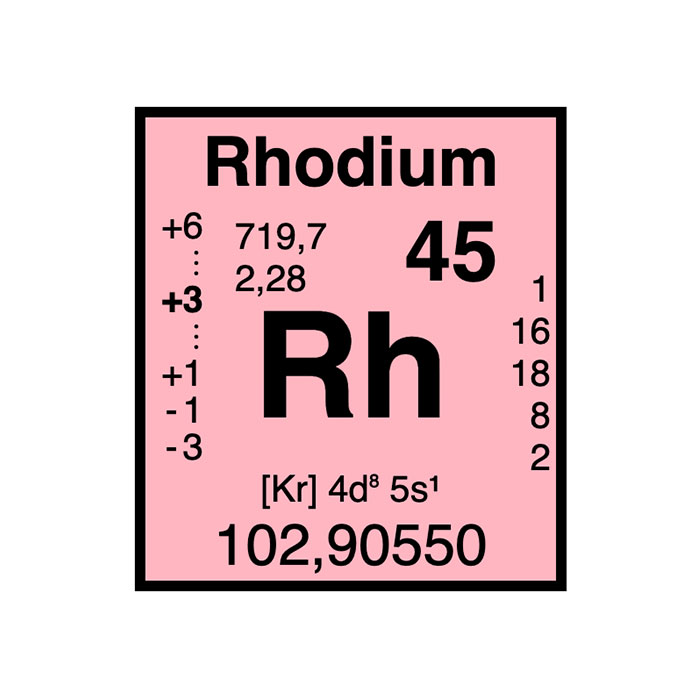
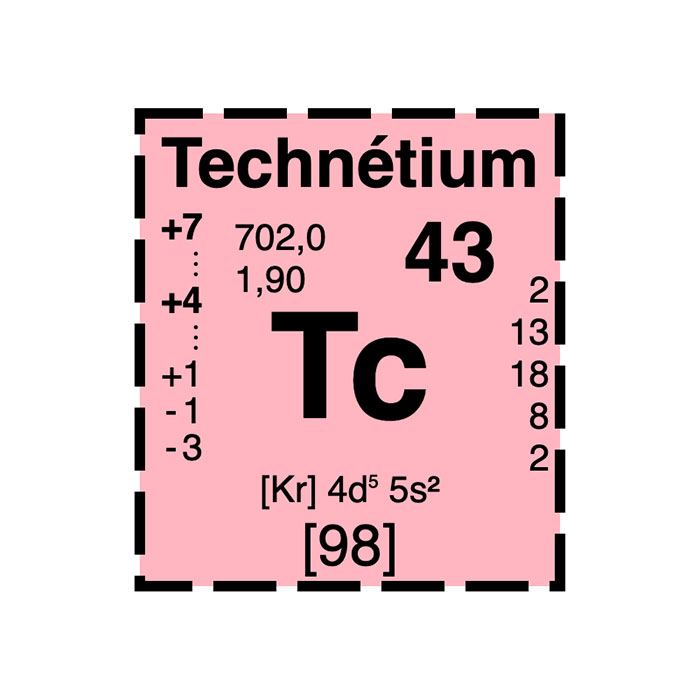
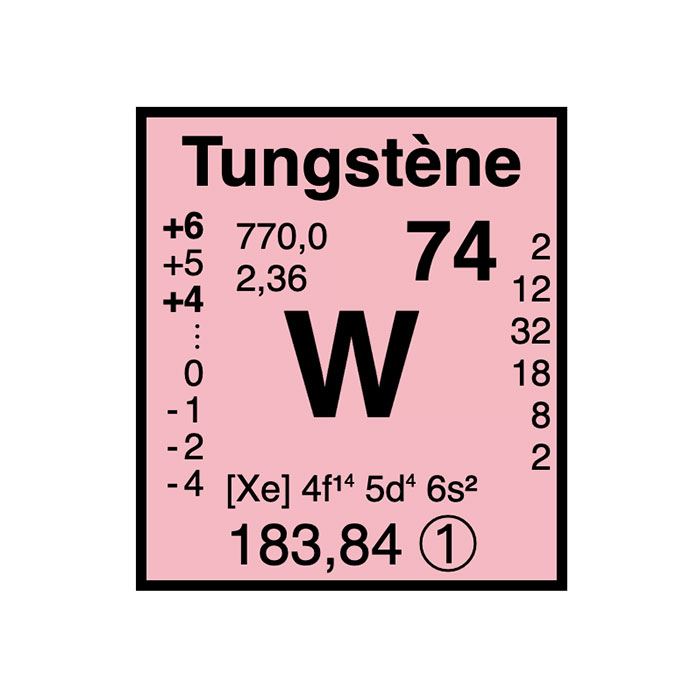
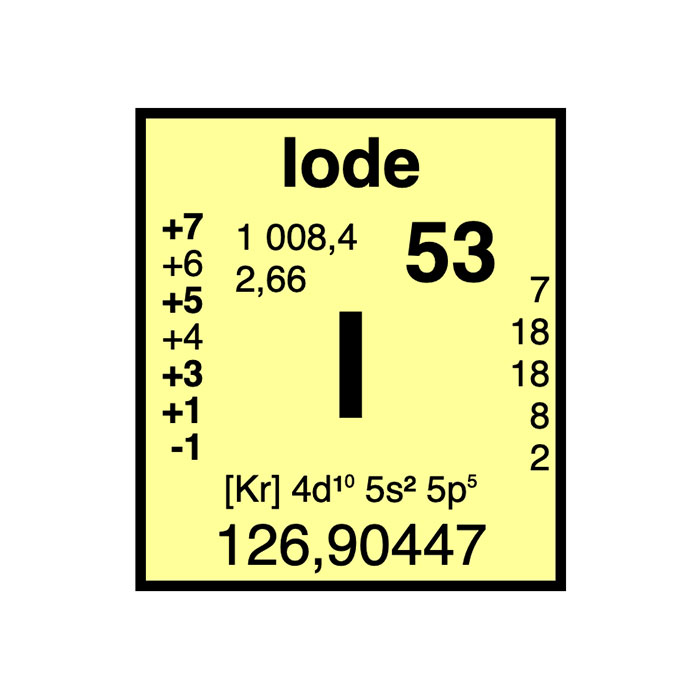
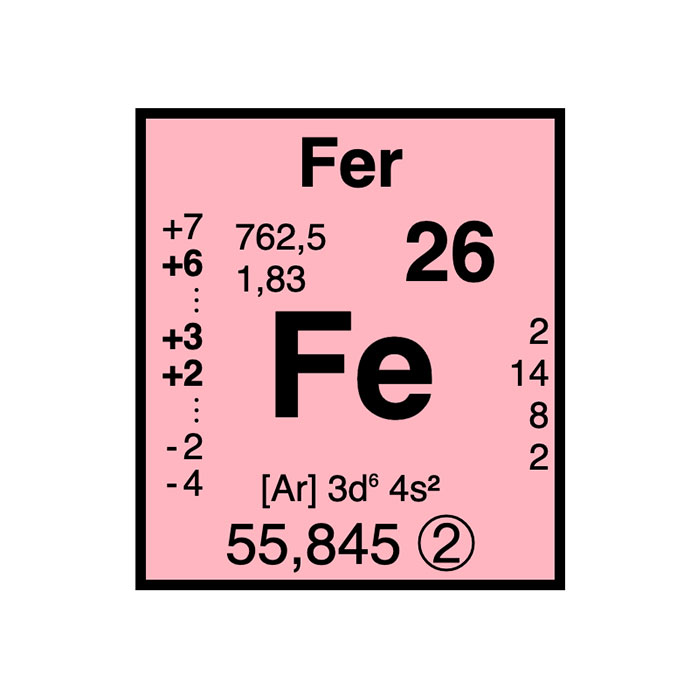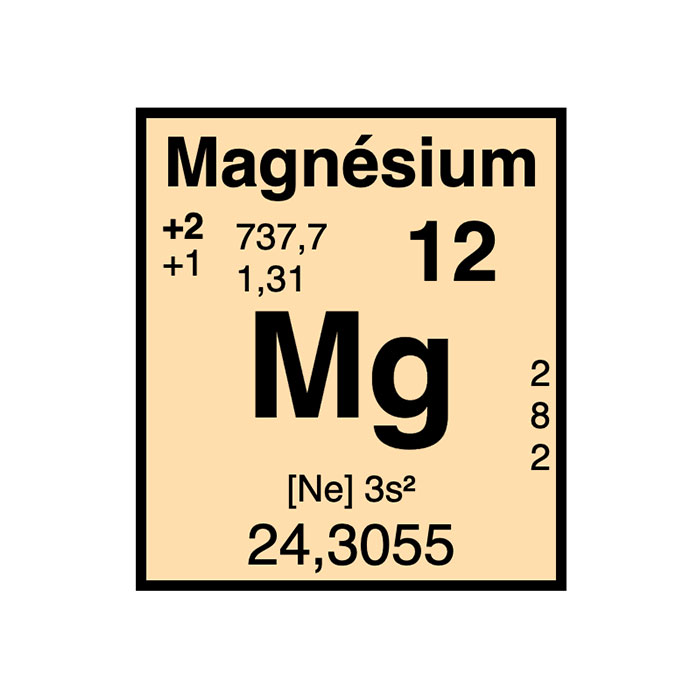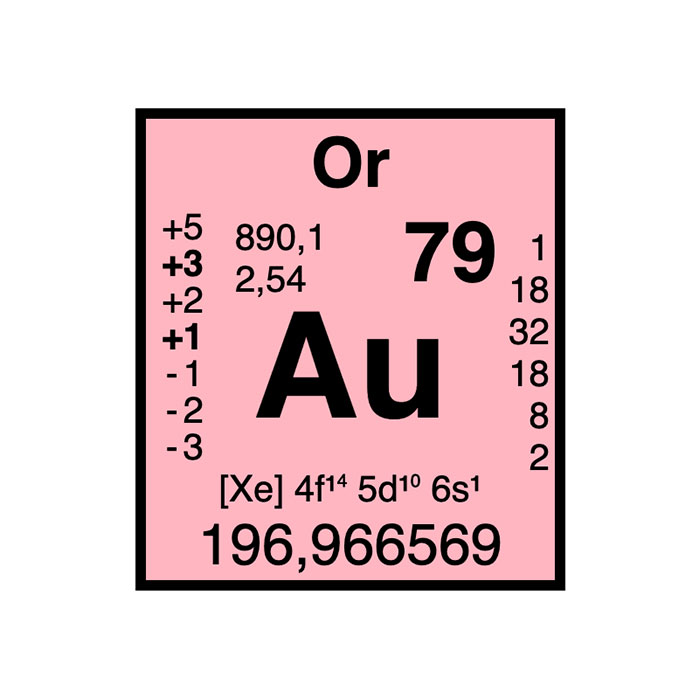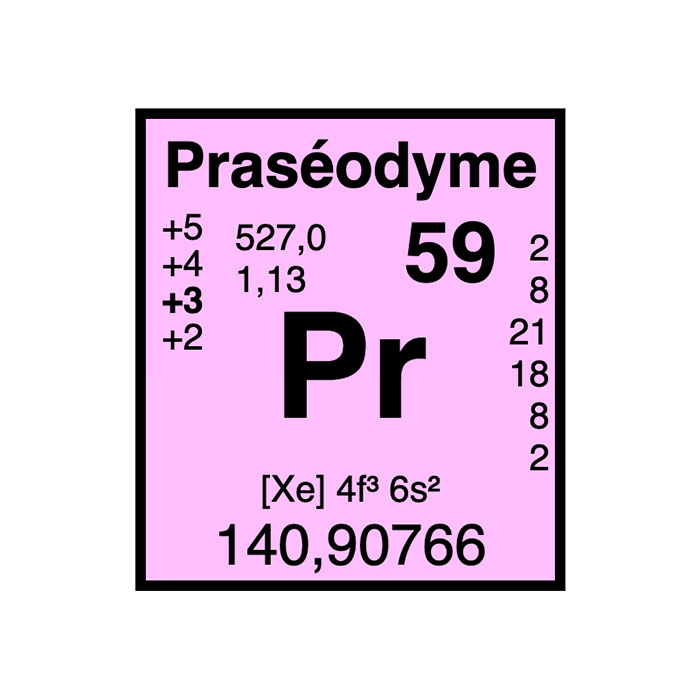Actínidos
Los actínidos: propiedades, radioactividad, compuestos, toxicidad, abundancia, extracción, aplicaciones, descubrimiento, síntesis, identificación y su producción.Constituyendo una familia de la tabla de Mendeléyev, los actínidos comprenden quince elementos químicos. Se trata de metales pesados que se distinguen por sus propiedades químicas relacionadas. En general, a veces se designan bajo el símbolo químico colectivo "An". Este último representa todos los tipos de actínidos.La mayoría de los actínidos pertenecen al bloque f, excepto el lawrencio, que es un elemento del bloque d. A diferencia de los lantánidos, estos metales tienen un número de valencia variable. De hecho, presentan un radio iónico y un