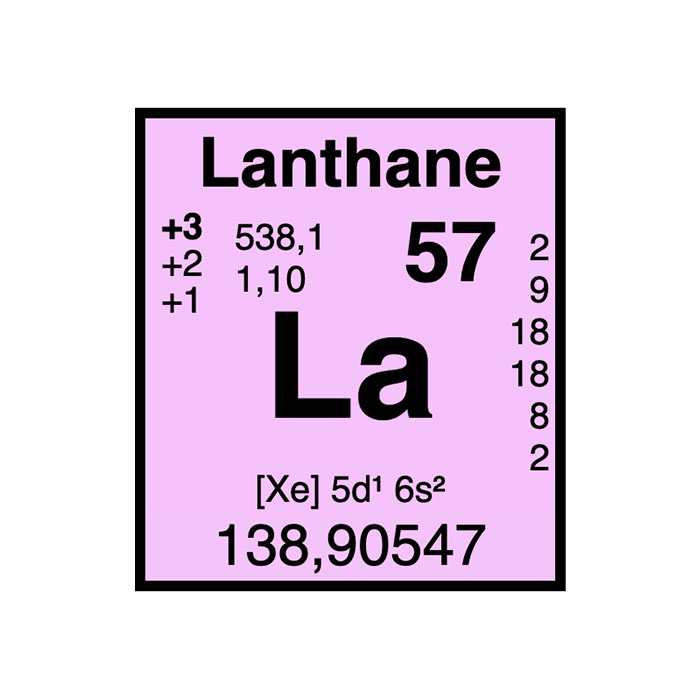
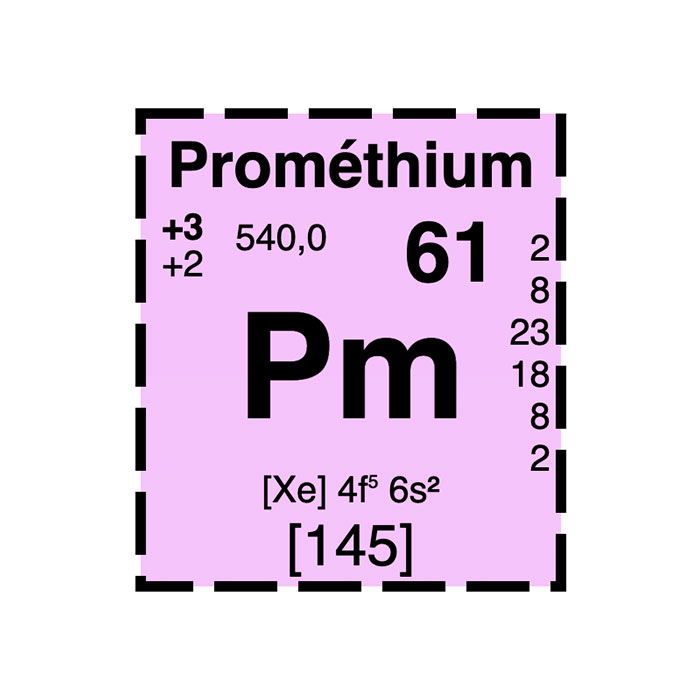
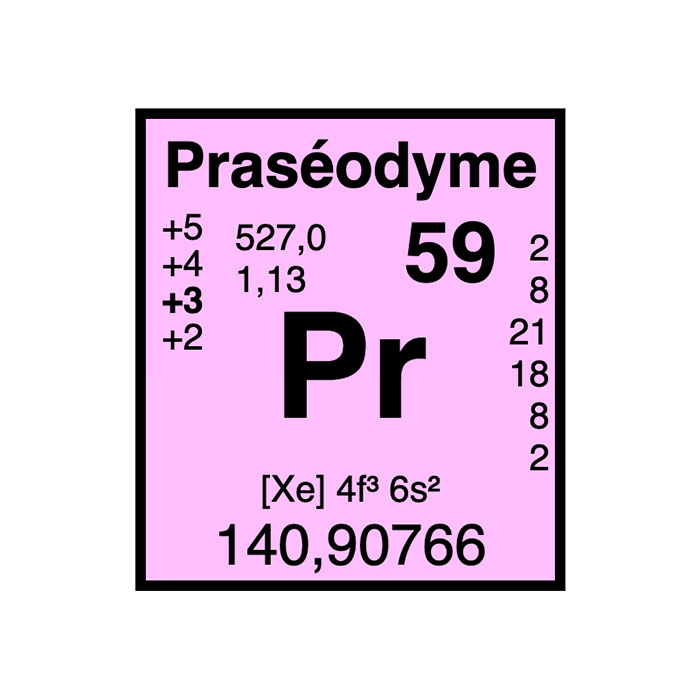Cerio
El cerio, elemento atómico n°58 de símbolo Ce: su descubrimiento, sus isótopos, sus propiedades y sus usos.De número atómico 58, el cerio es el elemento químico de símbolo Ce. Pertenece a la familia de los lantánidos.El descubrimiento del cerioEn 1803, el cerio fue descubierto por Martin Heinrich Klaproth. Durante el mismo período, Jöns Jacob Berzelius y Wilhelm Hisinger también lo identificaron. Su nombre proviene de Ceres, un planeta enano descubierto en enero de 1801. Su forma pura fue aislada por primera vez por Carl Gustav Mosander en 1825.Los isótopos del cerioEl elemento 58 posee cuatro isótopos: 136Ce, 138Ce, 140Ce y